Физико-химические основы электрохимической обработки воды
© Мосин О.В.
Явление электрохимической активации воды (ЭХАВ) – совокупность электрохимического и электрофизического воздействия на воду в двойном электрическом слое (ДЭС) электродов (анода и катода) при неравновесном переносе заряда через ДЭС электронами и в условиях интенсивного диспергирования в жидкости образующихся газообразных продуктов электрохимических реакций.
В процессе ЭХАВ происходят четыре основных процесса:
1) Электролитическое разложение воды (электролиз) за счет окислительно-восстановительных реакций на электродах, обусловленных внешним постоянным электрическим полем;
2) Электрофорез – движение в электрическом поле положительно заряженных частиц и ионов к катоду, а отрицательно заряженных частиц и ионов к аноду;
3) Электрофлотация – образование газовых флокул и агрегатов, состоящих из мелкодисперстных пузырьков газа (водорода на катоде и кислорода на аноде) и грубодисперстных примесей воды;
4) Электрокоагуляция – образование коллоидных агрегатов частиц осаждаемой дисперсной фазы за счет процесса анодного растворения металла и образования катионов металлов Al3+, Fe2+, Fe3+ под воздействием постоянного электрического поля .
В результате обработки воды постоянным электрическим током, при потенциалах равных или превышающих потенциал разложения воды (1,25 V) вода переходит в метастабильное состояние, характеризующееся аномальными значениями активности электронов и других физико-химических параметров (рН, Eh, ОВП, электропроводность) [1]. Прохождение постоянного электрического тока через объем воды сопровождается электрохимическими процессами, в результате которых происходят окислительно-восстановительные реакции, приводящие к деструкции (разрушению) водных загрязнений, коагуляции коллоидов, флокуляции грубодисперсных примесей и их последующей флотации.
Электрохимическая обработка применяется для осветления и обесцвечивания природных вод, их умягчения, очистки от тяжелых металлов (Cu, Co, Cd, Pb, Hg), хлора, фтора и их производных, для очистки сточных вод, содержащих нефтепродукты, органические и хлорорганические соединения, красители, СПАВ, фенол [2]. Достоинствами электрохимической очистки воды является то, что она позволяет корректировать значения водородного показателя рН и окислительно-восстановительного потенциала Еh, от которого зависит возможность протекания различных химических процессов в воде; повышает ферментивную активность активного ила в аэротенках; уменьшает удельное сопротивление и улучшает условия коагуляции и седиментации органических осадков [3].
В 1985 г ЭХАВ была официально признана в качестве нового класса физико-химических явлений. Поручением правительства РФ от 15 января 1998 г. № ВЧ-П12-01044 даны рекомендации министерствам и ведомствам использовать данную технологию в медицине, сельском хозяйстве, промышленности.
Электролиз воды
Основной стадией электрохимической обработки воды является электролиз воды. При пропускании постоянного электрического тока через воду, поступление в воду электронов у катода, так же как и удаление электронов из воды у анода, сопровождается серией окислительно-восстановительных реакций на поверхности катода и анода. В результате образуются новые вещества, изменяется система межмолекулярных взаимодействий, состав воды, в том числе структура воды [4].
Типовая установка для электрохимической обработки воды состоит из блока подготовки воды (1), электролизера (2), блока обработки воды после электрохимической очистки (3) (рис. 1).
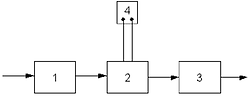
Рис. 1. Схема установки для электрохимической обработки воды: 1 – блок подготовки воды; 2 – электролизер; 3 – блок доочистки; 4 –выпрямитель электрического тока.В некоторых установках электрохимической обработки воды предусматривается предварительная механическая очистка воды, уменьшающая опасность засорения электролитической ячейки грубодисперсными примесями с большим гидравлическим сопротивлением. Блок для механической очистки воды необходим, если в результате электрохимической обработки вода насыщается грубодисперсными примесями, например хлопьями гидрооксидов металлов (Al(OH)3, Fe(OH)3, Mg(OH)2) после электрокоагуляции. Основным элементом установки является – электролизер, состоящий из одной или нескольких электролизных ячеек (рис. 2).
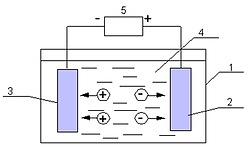
Рис. 2. Схема электролизной ячейки: 1 – корпус; 2 – анод; 3 – катод; 4 – межэлектродное пространство; 5 – источник постоянного тока.Электролизная ячейка образована двумя электродами – положительно заряженным анодом и отрицательно заряженным катодом, присоединенными к разным полюсам источника постоянного тока. Межэлектродное пространство заполнено водой, являющейся электролитом, способным проводить электрический ток. В результате работы прибора происходит перенос электрических зарядов через слой воды – электрофорез, т.е. миграция полярных частиц, носителей зарядов - ионов, к электродам, имеющим противоположный знак. При этом к аноду перемещаются отрицательно заряженные - анионы, а к катоду – положительно заряженные катионы. У электродов заряженные ионы теряют заряд, деполяризуются, превращаясь в продукты распада. Кроме заряженных ионов в электрофорезе участвуют полярные частицы различной дисперсности, включая и грубодисперсные (эмульгированные частицы, пузырьки газов и др.), но главную роль в переносе электрохимических зарядов играют обладающие наибольшей подвижностью заряженные ионы. К полярным частицам относятся полярные частицы из числа водных примесей и молекулы воды, что объясняется их особой структурой. Входящий в состав молекулы воды центральный атом кислорода, имеющий большую электроотрицательность, чем атомы водорода, оттягивает на себя электроны, придавая молекуле асимметричность. В результате происходит перераспределение электронной плотности: молекула воды поляризуется, принимая свойства электрического диполя (дипольный момент 1,85 дебая) с положительным и отрицательным зарядами на полюсах (рис. 3).
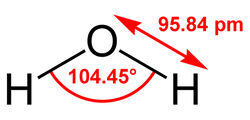
Рис. 3. Структура молекулы водыПродуктами электродных реакций являются обезвреженные водные примеси, газообразные водород и кислород, образующиеся при электролитическом разрушении молекул воды, катионы металлов (Al3+, Fe2+, Fe3+,) в случае применения металлических анодов из аллюминия и стали, молекулярный хлор и др. При этом на катоде генерируется газообразный водород, а на аноде – кислород. В составе воды содержится некоторое количество иона гидроксония Н3О+, деполяризующегося на поверхности катода с образованием атомарного водорода Н. :
Н3О+ + е- → Н + Н2О
В щелочной среде Н3О+ отсутствует, но происходит разрушение молекул воды, сопровождающееся образованием атомарного водорода Н. и гидроксид-иона ОН-:
Н2О + е- → Н + ОН-
Реакционноспособные атомы водорода адсорбируются на поверхностях катодов и после рекомбинации образуют молекулярный водород Н2 , выделяющийся из воды в газообразном виде:
Н + Н → Н2
Одновременно у анодов происходит выделение атомарного кислорода. В кислой среде этот процесс сопровождается разрушением молекул воды:
2Н2О – 4е- → О2 + 4Н+
В щелочной среде источником образования кислорода служат гидроксид-ионы ОН-, перемещающиеся под действием электрофореза от катода к аноду:
4ОН- → О2 + 2Н2О + 4е-
Нормальные окислительно-восстановительные потенциалы этих реакций: +1,23 V и +0,403 V, соответственно, но процесс протекает в условиях некоторого перенапряжения.
Электролизную ячейку можно рассматривать в качестве генератора вышеназванных продуктов, некоторые из которых, вступая в химическое взаимодействие между собой и с водными загрязнениями в межэлектродном пространстве, обеспечивают дополнительную химическую очистку воды (электрофлотация, электрокоагуляция) [5]. Эти вторичные процессы происходят не на поверхности электродов, а в объеме воды. Поэтому в отличие от электродных процессов они обозначаются объемными. Они инициируются повышением температуры воды в процессе электролиза и увеличением значения рН при катодном разрушении молекул воды.
Различают катодное и анодное окисление. При катодном окислении молекулы органических веществ, сорбируясь на катодах, акцептируют свободные электроны, восстанавливаются, трансформируясь в в соединения, не являющиеся загрязнениями. В одних случаях процесс восстановления проходит в один этап:
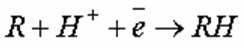
где R – органическое соединение; RH – гидратированная форма соединения, не являющаяся загрязнением.
В других случаях катодное восстановление проходит в два этапа: на первом этапе (I) органическая молекула превращается в анион, на втором (II) – анион гидратируется, взаимодействуя с протоном воды:
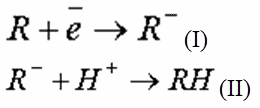
Катоды из материалов, требующих высокого перенапряжения (свинец, кадмий), позволяют при большой затрате электроэнергии разрушать органические молекулы и генерировать реакционноспособные свободные радикалы - частицы, имеющие на внешних орбитах атомов или молекул свободные неспаренные электроны (Cl*, O*, ОН*, НО2* и др.). Последнее обстоятельство придает свободным радикалам свойство реакционноспособности, т.е. способости вступать в химические реакции с водными примесями и разрушать их.
При анодном окислении молекулы органического вещества, адсорбируясь на аноде, отдают электроны с одновременной или с предшествующей гидратацией:
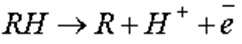
Анодное окисление органических соединений часто приводит к образованию свободных радикалов, дальнейшие превращения которых определяются их реакционной способностью. Процессы анодного окисления многостадийны и протекают с образованием промежуточных продуктов. Анодное окисление снижает химическую устойчивость органических соединений и облегчает их последующую деструкцию в ходе объемных процессов [6].
В объемных окислительных процессах особую роль играют продукты электролиза воды – кислород (О2), перекись водорода (Н2О2) и кислородосодержащие соединения хлора (HClO). В процессе электролиза образуется чрезвычайно реакционноспособное соединение - Н2О2, формирование молекул которой происходит за счет гидроксил-радикалов (ОН*), являющихся продуктами разрядки на аноде гидроксил-ионов (OH-):
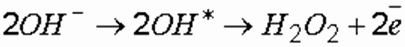
где ОН* – гидроксил-радикал.
Реакции взаимодействия органических веществ с окислителями протекают в течение определеного промежутка времени, длительность которого зависит от величины окислительно-восстановительного потенциала элемента и концентрации реагирующих веществ. По мере очистки и снижения концентрации загрязняющего вещества процесс окисления уменьшается.
Скорость процесса окисления при электрохимической обработке зависит от температуры обрабатываемой воды и от рН. В процессе окисления органических соединений образуются промежуточные продукты, отличающиеся от исходного как устойчивостью к дальнейшим превращениям, так и показателями токсичности.
Источником получения активного хлора и его кислородосодержащих соединений, генерируемых в электролизере, являются хлориды, находящиеся в обрабатываемой воде, и хлористый натрий (NaCl), который вводится в обрабатываемую воду перед электролизом. В результате анодного окисления анионов Cl- генерируется газообразный хлор Cl2. В зависимости от рН воды он либо гидролизуется с образованием хлорноватистой кислоты HOCl, либо образует гипохлорит-ионы ClO-. Равновесие реакции зависит от значения рН. При рН = 4–5 весь хлор находится в форме хлорноватистой кислоты (HClO), а при рН = 7 половина хлора в форме гипохлорит-иона (OCl-) и половина – в виде хлорноватистой кислоты (HClO) (рис. 4).
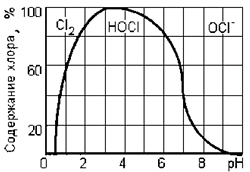
Рис.4. Содержание (%) различных форм хлора (Cl2, HOCl, OCl-) в воде в зависимости от рН.Механизм взаимодействия гипохлорит-иона (ClO-) с окисляемым веществом описывается следующим уравнением:
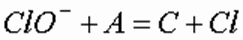
где А – окисляемое вещество; С – продукт окисления.
Электрохимическое окисление органических соединений гипохлорит-ионом (ClO-) сопровождается увеличением окислительно-восстановительного потенциала Eh, что указывает на преобладание окислительных процессов [7]. Рост Eh зависит от отношения концентрации активного хлора в межэлектродном пространстве к содержанию органических примесей в воде. По мере очистки и уменьшения количества загрязнений это соотношение возрастает, что приводит к увеличению Eh, но потом этот показатель стабилизируется.
Количество вещества, прореагировавшего на электродах при пропускании постоянного электрического тока по закону Фарадея, прямо пропорционально силе тока и времени обработки:
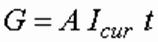
где А – электрохимический эквивалент элемента, г/А ч; Icur – сила тока, А; t – время обработки, ч.
Электрохимический эквивалент элемента определяется по формуле:
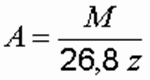
где М – атомная масса элемента, г; z – его валентность.
Значения электрохимических эквивалентов некоторых элементов приведены в табл. 1.
Таблица 1. Электрохимические эквиваленты некоторых элементов
Элемент
Электрохимический эквивалент вещества А, г/А ч
Водород
0,0376
Кислород
0,289
Железо двухвалентное
1,042
Железо трехвалентное
0,695
Алюминий
0,336
Хром трехвалентный
0,647
Хром шестивалентный
0,324
Медь двухвалентная
1,186
Цинк
1,22
Хлор
1,324
Кальций
0,748
Фактическое количество вещества, генерируемого при электролизе, меньше теоретического, рассчитанного по формуле (1), так как часть электроэнергии затрачивается на нагревание воды и электродов. Поэтому при расчетах учитывается коэффициент использования тока η < 1, величина которого определяется экспериментально.
При электродных процессах происходит обмен заряженных частицами и ионами между электродом и электролитом - водой. Для этого в установившихся равновесных условиях необходимо создание электрического потенциала, минимальная величина которого зависит от вида окислительно-восстановительной реакции и от температуры воды при 25 0С (табл. 2).
Таблица 2. Электродные потенциалы некоторых элементов
- Электродная реакция; Потенциал [V]; Электродная реакция; Потенциал [V]
- Al → Al3+ + 3e-; -1,66; Cu → Cu2+ + e-; +0,345
- Zn → Zn2+ + 2e-; -0,763; 4OH- → 2H2O + O2 + 4e-; +0,401
- Fe → Fe2+ + 2e-; -0,44; 2H2O → O2 + 4H+ + 4e-; +1,23
- Cd → Cd2+ + 2e-; -0,403; 2Cl- → Cl2 + 2e-; +1,36
- H2 → 2H+ + 2e-; 0,0001; Cl- + H2O → HClO + H+ + 2e-; +1,49
Напряжения, генерируемые в электродной ячейке, должны быть достаточными для возникновения окислительно-восстановительных реакций на электродах. Значение напряжения зависит от ионного состава воды, наличия в воде примесей, например СПАВ, плотности тока (его сила отнесенная к единице площади электрода), материала электродов и др. При прочих равных условиях задача выбора электродного материала заключается в том, чтобы для прохождения окислительно-восстановительных реакций на электродах, требуемое напряжение было минимальным, поскольку это позволяет снизить затраты электроэнергии.
Некоторые окислительно-восстановительные реакции являются конкурирующими - протекают одновременно и взаимно тормозят друг друга. Их протекание возможно регулировать за счет изменения напряжения в электролитической ячейке. Так, нормальный потенциал реакции образования молекулярного кислорода составляет +0,401 V или +1,23 V; при увеличении напряжения до +1,36 V (нормальный потенциал реакции образования молекулярного хлора) на аноде будет выделяться только кислород, а при дальнейшем увеличении потенциала – одновременно и кислород, и хлор, причем выделение хлора будет происходить с недостаточной интенсивностью. При напряжении около 4–5 V выделение кислорода практически прекратится, и электролитическая ячейка будет генерировать только хлор.
Расчет основных параметров процесса электролиза воды
К основным параметрам электролиза воды относятся сила и плотность тока, напряжение в пределах электродной ячейки, а так же скорость и продолжительность пребывания воды в межэлектродном пространстве.
Сила тока Icur – величина, определяемая в зависимости от требуемой производительности по генерируемому продукту, А, определяется по формуле:
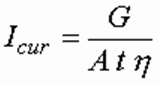
Эта формула получена путем преобразования формулы (1) с учетом коэффициента использования тока η.
Плотность тока – его сила, отнесенная к единице площади электрода, А/м2, например анода, определяется из выражения:
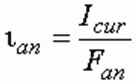
где Fan – площадь анода, м2.
Плотность тока оказывает определяющее влияние на электролиз: с увеличением плотности тока интенсифицируются электродные процессы и уменьшается площадь поверхности электродов, но одновременно возрастают напряжение в электролизной ячейке и как следствие энергоемкость процесса [8]. Повышенное увеличение плотности тока интенсифицирует выделение электролизных газов, приводящее к бурлению и диспергированию нерастворимых продуктов электрообработки воды. При увеличении плотности тока также усиливается пассивация электродов, заключающаяся в блокировке поступающих электронов поверхностными отложениями анода и катода, что увеличивает электрические сопротивления в электродных ячейках и тормозит окислительно-восстановительные реакции, протекающие на электродах.
Аноды пассивируются в результате образования на их поверхностях тонких оксидных пленок, в результате сорбции на анодах кислорода и других компонентов, которые, в свою очередь, сорбируют частицы водных примесей. На катодах образуются, в основном, карбонатные отложения, особенно в случае обработки воды с повышенной жесткостью. В силу этих причин плотность тока при электролизе воды должна назначаться минимальной по условиям устойчивого протекания необходимых окислительно-восстановительных реакций в ходе технологического процесса.
Напряжение в электродной ячейке, В, определяется по формуле
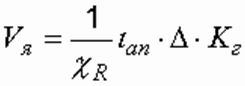
где ίan – плотность тока, А/м2; ∆ – расстояние между электродами (ширина межэлектродного канала), м; χR – удельная электропроводность воды, 1/(Ом.м); Кг – коэффициент газонаполнения межэлектродного пространства, Кг = 1,05–1,2.
Формула (5) не учитывает электрических сопротивлений электрода в связи с их низкими значениями, но при пассивации эти сопротивления оказываются значительными. Ширина межэлектродного канала принимается минимальной (3–20 мм) по условиям незасорения примесями.
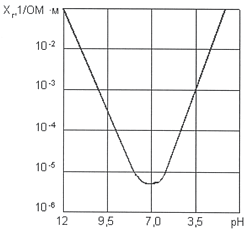
Рис. 5. Зависимость удельной электропроводности от рН воды при t = +5 0CУдельная электропроводность воды χR зависит от ряда факторов, среди которых наиболее существенны температура, рН, ионный состав и концентрация ионов (рис. 5). С увеличением температуры электропроводность χR увеличивается, а напряжение уменьшается (рис. 6). Минимальное значение электропроводности соответствует значению рН = 7. Кроме этого, в процессе электролиза происходит повышение температуры и рН воды. Если рН >7, то можно ожидать уменьшения удельной электропроводности воды χR, а при значениях рН < 7 удельная электропроводность воды χR, наоборот, возрастает (рис. 5).
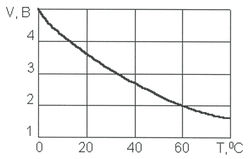
Рис. 6. Зависимость напряжения на электродах от температуры воды.Удельная электропроводность природных вод средней минерализации составляет 0,001–0,005 1/(Ом.м), городских сточных вод 10–0,01 1/(Ом.м) [9]. При электролизе удельная электропроводность должна быть в пределах 0,1–1,0 1/(Ом.м) [10]. В случае, если исходная вода имеет недостаточную электропроводность, следует увеличить солесодержание (рис. 7). Обычно для этого используют хлористый натрий (NaCl), дозы которого определяются экспериментально и чаще всего составляют 500–1500 мг/л (8–25 мг-экв/л) [11]. Хлористый натрий не только удобен по условиям применения и безопасности (хранение, приготовление раствора и т.д.), но в присутствии NaCl замедляется пассивация электродов. Диссоциируя в воде, NaCl насыщает воду анионами хлора Cl- и катионами натрия Na+. Ионы хлора Cl- имеют небольшие размеры и проникая через пассивирующие отложения к поверхности анода разрушают эти отложения. В присутствии других анионов, особенно сульфат ионов (SO42-), депассивирующее влияние ионов хлора (Cl-) уменьшается. Устойчивая работа электролизера возможна в случае, если ионы Cl- составляют не менее 30% от общего количества анионов. Катионы натрия Na+ в результате электрофореза перемещаются к катодам, на которых генерируются гидроксид-ионы ОН-, и, взаимодействуя с последними, образуют гидроксид натрия (NaОН), растворяющий карбонатные отложения на катодах.
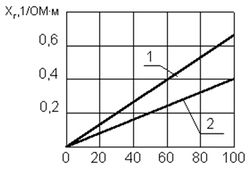
Рис. 7. Зависимость электропроводности от концентрации анионов хлора : 1 - при t= +25 0С; 2 - при t= +5 0С
Потребляемая мощность, Вт, электролизера определяется по зависимости (6):
Nпотр = ηэ Icur Vэ (6)
где ηэ – коэффициент полезного действия электролизера, ηэ = 0,7–0,8; Icur – сила тока, A, Vэ – напряжение на электролизере, V.
Продолжительность пребывания воды в межэлектродном пространстве электролизера ограничивается временем, необходимым для генерации нужного количества продуктов электролиза, а также продолжительностью соответствующих объемных реакций, и определяется экспериментально.
Скорость движения воды в межэлектродом пространстве задается с учетом условий выноса из электролизера продуктов электролиза и других примесей; кроме того, от скорости движения воды зависит турбулентное перемешивание, что влияет на ход объемных реакций. Как и продолжительность пребывания воды, скорость воды выбирается на основании экспериментальных данных.
Конструкции электролизеров воды
Современные электролизеры представляют собой камеры различных конфигураций, в которых размещены электроды. Камеры выложены листовым винипластом или текстолитом для защиты от воздействия хлора, его кислородных соединений и других окислителей.
Электролиз воды сопровождается интенсивным пеновыделением, поэтому электролизер оборудуется специальными устройствами и пеногасителями для ее удаления. В целях защиты электродов и межэлектродного пространства от засорения пеной и нерастворимыми продуктами электролиза предусматриваются устройства для очистки межэлектродного пространства путем продувки сжатым воздухом или при помощи специальных диэлектрических щеток, которые предназначаются и для механической депассивации электродов. Электроды имеют форму пластин с центральным отверстием, через которое проходит вал с жестко закрепленными на нем скребками (щетками), заведенными в межэлектродные зазоры. При повороте вала происходит контакт щеток с электродами, что позволяет очищать их от твердых отложений.
Если вода содержит грубодисперсные примеси с большим гидравлическим сопротивлением, предусматривается специальная иловая камера для накопления выпадающих осадков (рис. 8).
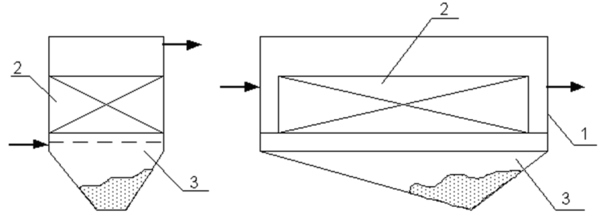
Рис. 8. Схемы электролизеров с осадконакопителями: 1 – корпус; 2 – блок электродов; 3 – осадконакопитель
В зависимости от направления движения воды электролизеры бывают горизонтального или вертикального типов (рис. 9). Вертикальная установка занимает меньшую площадь, но имеет большую высоту, что усложняет высотную схему сооружения.
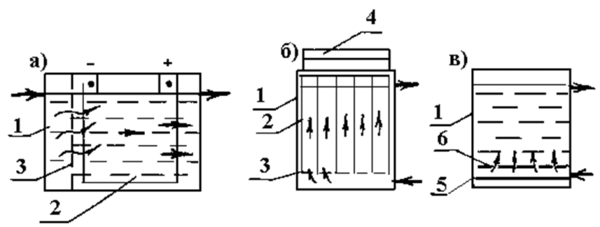
Рис. 9. Схемы электродных камер: а – горизонтальная прямоугольная; б – вертикальная прямоугольная или круглая; в – то же с горизонтальным расположением электродов; 1 – корпус; 2 – электроды; 3 – распределительная решетка; 4 – блок электропитания; 5 – анод; 6 – катод в виде сетки.
Электроды выполняются в виде стрежней, дисков, сеток и т.д., но чаще всего представляют собой металлические стальные пластины толщиной от 3 до 10 мм. Во избежание химической коррозии их размеры составляют 1,5–1,8 м. Пластины собираются в пакеты при помощи диэлектрических стягивающих зажимов либо устанавливаются в пазы специальных рам из диэлектриков (рис.10, рис. 11).
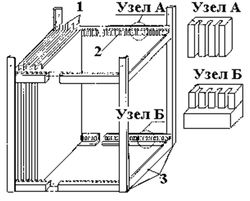
Рис. 10. Схема электродной системы пазного типа. 1 – электроды; 2 – контактные пазы; 3 – рама.По условиям монтажа и ремонтопригодности вес пластин или пакетов пластин должен составлять не более 50–100 кг. Поэтому при необходимости в корпусе электролизера может размещаться несколько пакетов пластин.
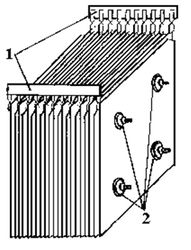
Рис. 11. Схема электродной системы пакетного типа: 1 – токораспределительные пластины; 2 – стягивающие зажимы.Электроды присоединяются к источнику электропитания по монополярной или по биполярной схеме. В последнем случае каждый электрод работает одной поверхностью как анод, а другой – как катод. Биполярная схема требует меньшего количества присоединений электродов к источнику питания, но при этом увеличивается напряжение на электродах. Если при монополярном присоединении оно равно напряжению в пределах одной электродной ячейки, т.е. Vэ = Vя, то при биполярной напряжение на электродах зависит от количества ячеек, n:
Vэ = n Vя, (7)
где n – количество ячеек, шт.
Материал электродов должен обладать рядом обязательных свойств:
1) химической устойчивостью и инертностью к среде, в которой производится электролиз;
2) оптимальными электрохимическими характеристиками по отношению к окислительно-восстановительным реакциям;
3) механической прочностью и химической устойчивостью.
Аноды (за исключением установок для электрокоагуляции) не должны растворяться при электролизе. Нерастворимые аноды изготавливаются титановыми с защитными покрытиями из платины, оксидов кобальта (ОКТА), диоксида марганца (ТДМА), оксидов рутения и титана (ОРТА) [12]. Возможно применение анодов из графита или графитизированного угля, но эти материалы недостаточно прочны и долговечны. В электрокоагуляторах аноды выполняются растворимыми из алюминия и его сплавов, а также из железа.
В процессе электролиза всегда генерируются газообразные водород и кислород. Смесь этих газов взрывоопасна, а смесь водорода с воздухом обладает взрывоопасностью при концентрации водорода более 4 об.%. Согласно условиям безопасности электролизеры оборудуются системами вытяжной вентиляции, обеспечивающими разбавление выделяющегося водорода воздухом до концентрации менее 0,4 об.%, т.е. в 10 раз ниже порога взрывоопасности.
Производительность вентиляционных установок для электролизеров непрерывного действия, м3/ч рассчитывается по формуле:
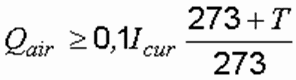
где t – температура обрабатываемой воды, 0С.
Если электролизер периодического действия, то формула принимает вид:
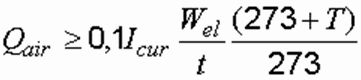
где Wel – полезная вместимость электродной камеры, м3; t – продолжительность обработки, ч.
В случаях, когда применяется открытый электролизер и генерируемый водород поступает непосредственно в помещение, кратность воздухообмена, 1/ч, расчитывается из формулы:
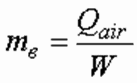
где W – объем помещения, м3.
Электролиз воды всегда сопровождается выделением тепла и нагревом обрабатываемой воды, что может повлиять на условия ее последующего использования или выпуска в систему водоотведения.
Расход выделяющегося при электролизе воды тепла, кДж/ч, равен:
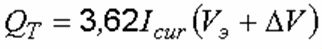
где ∆V – напряжение разложения поваренной соли. При ίan = 200 А/м2, ∆V = 2,1 V.
Температура обрабатываемой воды 0C в электролизе определяется из формулы:
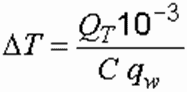
где С – объемная теплоемкость воды, кДж/(л град.); qw – расчетный расход воды, м3/ч.
Бытовые электрохимические реакторы
В бытовых условиях для электролиза воды чаще всего применяется дифрагменный проточный электрохимический реактор (СТЭЛ) [13], включающий электролизную ячейку, состоящую из катода и анода, разделенных специальной полупроницаемой мембраной (диафрагмой), разделяющую воду на щелочную фракцию - католит и кислую фракцию – анолит (рис. 12).
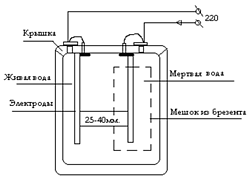
Рис. 12. Схема бытового электролизера для получения электроактивированных растворов воды.В результате катодной (католит) обработки вода приобретает щёлочную реакцию: её ОВП снижается, уменьшается поверхностное натяжение, снижается количество растворённого в воде кислорода, возрастает концентрация водорода, гидроксильных ионов (ОН-), уменьшается электропроводность воды, изменяется структура не только гидратных оболочек ионов, но и самой воды [14]. По внешним характеристикам католит – мягкая, светлая, с щелочным привкусом вода, иногда с белым осадком; её рН = 10-11 ед, ОВП = -200 – -800 мВ.
По физико-химическим параметрам католит является раствором с заметно усиленными электронодонорными свойствами и, попадая в физиологические жидкости организма способен усиливать электронодонорный фон на несколько десятков милливольт [15]. Антибактериальное действие католита диффренцированное: бактерицидный эффект проявляется относительно энтеробактерий, устойчивыми к нему являются энтерококки и стрептококки группы В, а в отношении грамотрицательных микроорганизмов - только бактериостатическое [16].
Электрохимически активированные растворы католита, в зависимости от силы пропускаемого тока могут быть нескольких видов:
К - католит щелочной (рН > 9, ОВП = 700-820 мВ), активные компоненты NaOH, О2, НО2-, НО2*·, ОН-, ОН*, НО2-, О2;
КН- католит нейтральный (рН = 9, ОВП = 300-500 мВ), активные компоненты О2, НО2-, НО2*, Н2О2, Н+, ОН-.
При анодной (анолит) электрохимической обработке кислотность воды увеличивается, ОВП возрастает, несколько уменьшается поверхностное натяжение воды, увеличивается электропроводность, возрастает количество растворённого в воде кислорода, хлора, уменьшается концентрация водорода, изменяется структура воды [17]. По внешним признакам анолит— коричневатая, кисловатая, с характерным запахом и вкусом жидкость с рН = 4-5 ед и ОВП = +500+1100 мВ. По параметрам токсичности анолит при введении в желудок и нанесении на кожу относится к 4 классу малоопасных веществ по ГОСТ 12.1.007-76 и обладает в данном классе минимальной токсичностью. При ингаляционном введении анолит с содержанием оксидантов 0,02% и общей минерализацией 0,25-0,35% не оказывает раздражающего действия на органы дыхания и слизистые оболочки глаз. При введении внутрь анолит не оказывает иммунотоксического действия и повышения уровня хромосомных аберраций в клетках костного мозга и других тканях и не обладает цитогенетической активностью. При нагревании до 50 С бактерицидная активность анолита увеличивается на 30-100% [18].
Электрохимически активированные растворы анолита подразделяются на четыре основных типа:
А - анолит кислотный (рН < 5, ОВП = + 800-1200 мВ), активные компоненты НСlО, Сl2, НСl, НО2*;
АН -анолит нейтральный (рН = 6, ОВП = + 600-900 мВ), активные компоненты НСlО, О3, НО-, НО2*;
АНК - анолит нейтральный (рН = 7,7, ОВП = + 250-800 мВ), активные компоненты НСlО, СlО-, НО2-, Н2О2, О2, Сl-, НО*;
АНД - анолит нейтральный (рН = 7,3, ОВП = +700-1100 мВ), активные компоненты НСlО, НСlО2, СlО-, СlО2*, НО2*, Н2О2, О2, О3, Сl-, НО-, О*.
На основании материалов, опубликованных в сборника Второго и Третьего Международных симпозиумов «Электрохимическая активация в медицине, сельском хозяйстве, промышленности», монографии Прилуцкого В.И. и Бахира В.М. [19] приводятся следующие данные о некоторых свойствах и лечебном действии анолита и католита:
Анолит обладает антибактериальным, противовирусным, антимикозным, антиаллергическим, противовоспалительным, противоотёчным, противозудным и подсушивающим действием, может оказывать цитотоксическое и антиметаболическое действие, не причиняя вреда клеткам тканей человека. Биоцидные вещества в электрохимически активированном анолите, не являются токсичными для соматических клеток, поскольку представлены оксидантами, подобными тем, которые продуцируют клетки высших организмов.
Католит обладает антиоксидантными, иммуностимулирующими, детоксицирующими свойствами, нормализует ОВП, метаболические процессы (повышение синтеза АТФ, изменение активности ферментов), стимулирует регенерацию тканей, повышает синтез ДНК и стимулирует рост и деление клеток за счёт увеличения массопереноса ионов и молекул через мембраны, улучшает трофические процессы и кровообращение в тканях.
Растворы анолитов и католитов находят применение в медицине в качестве антисептиков с целью дезинфекции и стерилизации инструментов, помещений, аппаратуры, предметов ухода, кожи и слизистых и т.д., а также для лечения гнойных ран [20]. Использование смоченных в анолите салфеток позволяет за 3-5 дней очистить поверхность ран, флегмонов, абсцессов, трофических язв, гнойно-некротических поражениях подкожной клетчатки, а последующее наружное применение католита в течение 5-7 дней существенно ускоряет репаративные процессы в тканях. Имеются также данные о высокой лечебной эффективности электроактивированных растворов воды при гастритах, язвенной болезни желудка, уретритах, эрозии шейки матки, язвах роговицы, инфекционных заболеваниях кожи, при лечении стоматитов, парадонтитов, а также при сахарном диабете. Одним из положительных свойств электроактивированных растворов воды является их дешевизна (20 рублей за литр) и экологичность.
Электролиз воды находит все более широкое применение во многих отраслях промышленности и в быту, в том числе в водоподготовке и водоочистке. Отечественной промышленностью выпускаются бытовые установки для проведения электролиза воды “СТЭЛ”, “Эсперо-1”, “Гейзер”, “Биомед” и др. Электроактивированные растворы католитов и анолитов производятся в бутилированном виде и продаются в аптеках и магазинах. Однако, фармакологические исследования электроактивированных растворов воды, как лекарственных средств – их фармакологическое действие и токсичность изучены не достаточно. В РФ такие исследования проводятся, в основном, на кафедре фармакологии Воронежской медицинской академии.
Заключение
Электрохимическая обработка воды обладает рядом преимуществ по сравнению с альтернативными механическими, химическими и биологическими методами водообработки и водоочиски. Эти преимущества заключаются в эффективности, устойчивости, контролируемости и удобном автоматическом регулировании процессов, а также простоте конструкции аппаратуры. Установки для электрохимической очистки воды компактны, имеют высокий уровень безотказности, требуют простой эксплуатации и могут быть полностью автоматизированы. С другой стороны, при электрохимической обработке воды возрастает энергопотребление, а в случае применения растворимых анодов расходуется тонколистовая сталь. Поэтому электрохимическая обработка обычно оказывается более выгодной для установок малой производительности (до 10-20 м3/час). В многоступенчатых схемах улучшения качества воды электрохимическая обработка может удобно сочетаться с другими методами водоподготовки.
Автор: О.В. Мосин
Литература
1.Бахир В.М., Лиакумович А.Г., Кирпичников П.А., Спектор Л.Е., Мамаджанов У.Д. “Физическая природа явлений активации веществ”, Изв. АН УзССР. Сер.техн. наук, 1, 60-64 (1983).
2. Кульский Л. А. Очистка воды электрокоагуляцией / Л.А. Кульский, П.П. Строкач, В.А. Слипченко и др., Будiвельник, Kiев (1978), 112 с.
3. Липовецкий Я.М. Электрохимические способы очистки питьевых и сточных вод / Я.М. Липовецкий, Я.Д. Рапопорт, ЦБНТИ Минжилкомхоза РСФСР, Москва (1985), 56 с.
4. Кирпичников П. А., Бахир В. М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С., Агаджанян С.И. “О природе электрохимической активации сред”, Докл. АН СССР, 286(3), 663-666 (1986).
5. Бахир В.М.,Задорожний Ю.Г. Электрохимические реакторы РПЭ, Гиперокс, Москва (1991), 35 c.
6. Яковлев С.В. Технология электрохимической очистки воды / С.В. Яковлев, И.Г. Краснобородько, В.М. Рогов. Л.О. Стройиздат, Ленинград (1987), 312 с.
7. Бахир В.М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. ВНИИИМТ, Москва (1999), 84 с.
8. Бахир В.М., Задорожний Ю.Г., Леонов Б.И., Паничева С.А., Прилуцкий В.И. Электрохимическая активация: очистка воды и получение полезных растворов, ВНИИИМТ, Москва (2001), 176 с.
9. Кульский Л.А. Справочник по свойствам, методам анализа и очистке воды: В 2-х частях. Часть 1 / Л.А. Кульский, И.Т. Гороновский, А.М. Когановский и др., Наукова думка, Киев (1980), 680 с.
10. Медриш Г.Л. Обеззараживание природных и сточных вод с использованием электролиза / Г.Л. Медриш, А.А. Тайшева, Д.Л. Басин., Стройиздат, Москва (1982), 80 с.
11. Воловник Г.И. Теоретические основы очистки воды / Г.И. Воловник, Л.Д. Терехов. Часть 1., Издательство ДВГУПС, Хабаровск (2000), 167 с.
12. Бахир В. М. Электрохимическая активация, ВНИИИ мед. техники, 2 часть, Москва (1992), 657 c.
13. Бабцова Н.Ф., Комаров И.Ф. Опыт использования установки СТЭЛ в хирургическом отделении. Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения. ч.1 (1999), с. 131-132.
14. Леонов Б.И., Прилуцкий В.И., Бахир В.М. Физико-химические аспекты биологического действия электрохимически активированной воды, ВНИИИМТ, Москва (1999), 244 с.
15. Бахир В.М. Теоретические аспекты электрохимической активации. / Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения, ч.1 (1999), с.39-49.
16. Торопков В.В., Альтшуль Э.Б., Торопкова Е.В. Токсикологическая характеристика препарата католит / Третий Международный симпозиум "Электрохимическая активация"// Доклады и краткие сообщения, Москва (2001), с.57-62.
17. Леонов Б.И., Бахир В.М., Вторенко В.И. Электрохимическая активация в практической медицине / Второй Международный симпозиум "Электрохимическая активация"// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с.15-23.
18. Торопков В.В.Альтшуль Э.Б., Пересыпкин О.И. Фармакологическая эффективность действия анолитов АН и АНК на слизистые оболочки ротовой полости / Второй Международный симпозиум "Электрохимическая активация"// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с. 93-95.
19. Прилуцкий В.И., Бахир В.М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия, ВНИИИМТ, Москва (1997), 228 с.
20. Паничева С.А. Новые технологии дезинфекции и стерилизации сложных изделий медицинского назначения, ВНИИИМТ, Москва (1998), 122 с.