Вода без воздуха (газов)
Вопрос:
Здравствуйте. Меня интересует следующий вопрос. Возможно ли в домашних условиях избавить воду от воздуха (газов)? И может «чистая вода» (Н2О), без других молекул, а, в частности, без воздуха (газов) кристаллизироваться (лед)? Спасибо заранее за ответ и замечательно-познавательный сайт :). Александр
Ответ:
Здравствуйте, уважаемый Александр. Большое спасибо за Ваш интерес к нашему сайту. Как известно из химии, существование абсолютно чистых веществ невозможно в природе – всякое вещество обязательно содержит примеси. Если имеющиеся в веществе примеси в пределах точности описания системы не оказывают влияния на изучаемые свойства, можно считать систему однокомпонентной; в противном случае гомогенную систему считают раствором.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). Даже обыкновенный воздух можно считать раствором газообразных кислорода (21 объёмных %), азота (78 объемных %) и углекислого газа (1 объёмный %).
Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер.
Одной из важнейших характеристик раствора является растворимость. Раствори́мость — способность вещества образовывать с другими веществами растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³).
Молярная концентрация С – число молей νВ растворенного вещества в одном литре раствора.
Нормальная концентрация N – число молей эквивалентов растворенного вещества (равное числу молей νВ, умноженному на фактор эквивалентности f) в одном литре раствора.
Моляльная концентрация m – число молей растворенного вещества в одном килограмме растворителя.
Процентная концентрация ω – число граммов растворенного вещества в 100 граммах раствора.

Концентрация компонента в растворе может изменяться от нуля до некоторого максимального значения, называемого растворимостью компонента.
Величина растворимости характеризует равновесие между двумя фазами, поэтому на неё влияют все факторы, смещающие это равновесие (в соответствии с принципом Ле Шателье – Брауна).
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Исторически сложились два подхода к образованию растворов – физическая теория, основы которой были заложены в XIX веке, и химическая, основоположником которой был Д.И. Менделеев.
Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными).
Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного. Современная термодинамика растворов основана на синтезе этих двух подходов.
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, к которым можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA-A и EB-B.
Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы.
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов). Растворимость жидких и твёрдых веществ в воде — практически только от температуры.
В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается.
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот.
Зависимость растворимости газов от давления выражается законом Генри – Дальтона, который гласит, что растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
С=kP
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе):
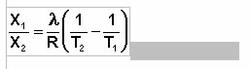
Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости также сильно зависит от концентрации других растворенных веществ.
Таблица.
Растворимость газов в воде (мольная - молярная долевая концентрация в состоянии термодинамического равновесия ) при парциальном давлении 101325 кПа в 1 л воды.
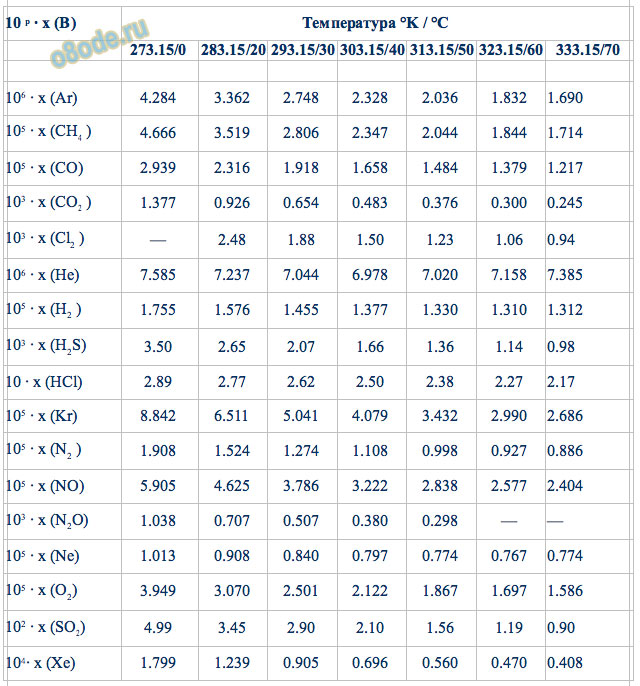
x (B) - мольная доля газа B, цифра в таблице соответствует мольной доле умноженной на приводной коэффициент из левого столбца. Т.е. x(Ar)=4,284*106 .
Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
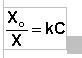
Таким образом, растворимость газов в воде зависит от ее температуры, и от их концентрации в воздухе, так называемом, парциальном давлении газа.
Ниже в таблице приведены данные по растворимости газов в воде в мл растворенного вещества на 100 г H2O при различных температурах и при их парциальном давлении, равном нормальному атмосферному давлению. Температура (в оС) указана верхним индексом при значении растворимости.
Таблица. Растворимость газов в воде.


В природной воде могут газов в воде быть растворены газы как воздушного (атмосферного), так и подземного происхождения. В наиболее пресной дождевой воде прежде всего растворяются кислород и азот. Как известно, воздушная смесь газов земной атмосферы в основном состоит из 79 частей азота и 21 части кислорода. Хотя растворимость кислорода почти в два раза выше растворимости азота, все же в воде азота растворяется почти в два раза больше, чем кислорода (рис. 12).
Как я уже сказал, растворимость в воде газов различна и зависит от ряда факторов: температуры, давления, минерализации, присутствия в водном растворе других газов. С повышением температуры до 90 °С растворимость газов в воде снижается, а затем возрастает. Так, в 1 л воды при температуре 20 °С растворяется 665 мл углекислого газа, а при 0°С — в три раза больше, 1713 мл. При температуре 0°С в 1 л воды может быть растворено, мл: гелия — 10, сероводорода — 4630, аммиака— 1 300000. Как видно из этих примеров, растворимость зависит и от состава самого газа.
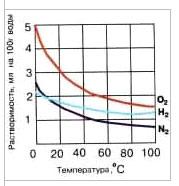
Рис. 12. Зависимость растворимости газов – кислорода, азота и водорода в воде от температуры (при атмосферном давлении).
А вот при повышении минерализации воды растворимость газа падает. Так, при 0°С растворимость кислорода в 1 л воды с минерализацией менее 1 г/л составляет 49 мл, а при минерализации 30 г/л — только 15, т. е. в три раза меньше.
Из всего сказанного можно сделать вывод о том, что растворимость газа в природной воде при постоянных температуре и степени минерализации прямо пропорциональна давлению газа на жидкость, для газовых смесей она пропорциональна давлению каждого газа в отдельности. Но это справедливо для сравнительно небольших давлений. При значительных давлениях, например на больших глубинах в океане, где давление подчас достигает сотен и даже тысячи атмосфер, на растворимость газов в воде влияет не парциальное давление отдельных газов, а общее давление всего столба воды.
Таким образом, суммируя вышесказанное можно сделать следующие выводы. Поскольку растворение газов в воде представляет собой экзотермический процесс, их растворимость с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Значит, простым кипячением воды можно удалить из воды весь растворенный в ней воздух.
Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом Ле Шателье, растворимость газов уменьшается. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и большую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала. Но при кипячении воды нарушается равновесие из-за улетучивания из неё газов, поэтому кипяченая вода, чтобы восстановить его, снова поглощает эти газы из воздуха. Поэтому на практике, растворимость многих газов в воде уменьшается до определённой предельной температуры (обычно 90 градусов по Цельсию), затем выше этой температуры растворимость газов в воде снова начинает возрастать.
Аквариумисты часто сталкиваются с таким явлением: при увеличении температуры воды рыбам становится труднее дышать, они поднимаются к поверхности и заглатывают воздух. Это как раз и связано с уменьшением растворимости кислорода. И растениеводом не рекомендуется поливать цветы кипячёной водой также по этой причине.
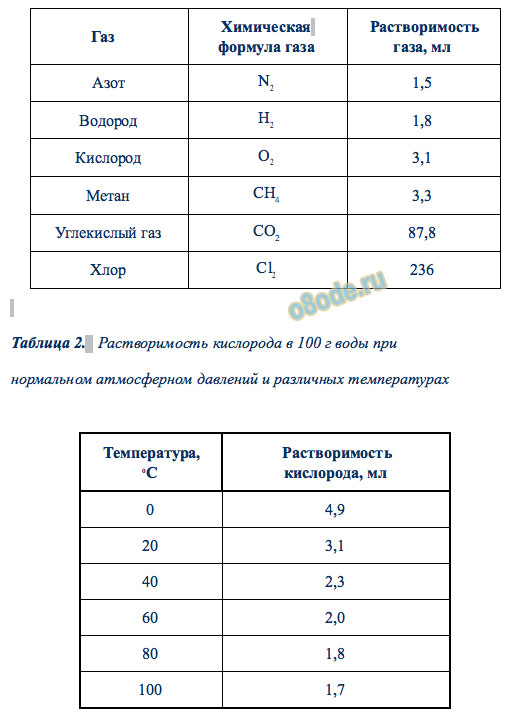
Таблица. Растворимость газов в 100 г воды при нормальном атмосферном давлении и температуре 20°C
Таблица 2. Растворимость кислорода в 100 г воды при нормальном атмосферном давлений и различных температурах
Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты; в подобных случаях с ростом температуры до определённого момента растворимость газа увеличивается.
С ростом давления растворимость газов увеличивается. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме жидкости при постоянной температуре, пропорциональна его давлению.
Закон Генри может быть выражен уравнением
С = kp
где С — массовая концентрация газа в насыщенном растворе; р— парциальное давление; k—коэффициент пропорциональности, называемый константой Генри (или коэффициентом Генри).
Это свойство используется для приготовления газированных напитков. Углекислый газ растворяют в жидкости при давлении 3–4 атм.; в этих условиях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с такой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского или выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.
Вообще, при растворении газа в жидкости устанавливается равновесие:
Газ + Жидкость = Насыщенный раствор газа в жидкости
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. И наоборот, уменьшение давления (создание вакуума) должно приводить к уменьшению растворимости газов в воде. Вот Вам второй способ уменьшить растворимость газов в воде – создание разрежения в ёмкости.
Влияние повышения давления на растворимость газа в воде видно из следующего примера. В системе водяного отопления восьмиэтажного здания (высота системы 23 м) наибольшая растворимость воздуха в воде наблюдается при температуре при температуре 95 °С
К этому же выводу можно прийти, исходя из динамического характера равновесия между газом и его раствором в жидкости. Молекулы газа, находящиеся над жидкостью в закрытом сосуде, бомбардируют поверхность жидкости и растворяются в жидкости со скоростью, пропорциональной концентрации газа. Перешедшие в раствор молекулы в свою очередь время от времени ударяются о поверхность жидкости изнутри и вылетают наружу. По мере того как в результате растворения концентрация растворенных молекул будет увеличиваться, скорость их выделения, т. е. число молекул, уходящих из раствора в единицу времени, тоже будет расти, пока, наконец, не сравняется со скоростью растворения. В результате установятся состояние равновесия, т. е. жидкость станет насыщенной газом.
Если теперь увеличить давление газа, например, в 2 раза, то во столько же раз увеличится и концентрация его молекул над жидкостью, а следовательно, и скорость растворения газа. Равновесие нарушится. Чтобы при новом давлении снова установилось равновесие, концентрация растворенных молекул, очевидно, тоже должна увеличиться вдвое.
Кроме вышесказанных методов удаления газов из воды кипячением воды и созданием вакуума имеются химические способы удаления газов из воды.
Чаще всего в процессе водоподготовки требуется удаление углекислоты, кислорода и сероводорода. Все три газа относятся к коррозийно-агрессивным газам, обусловливающим или усиливающим процессы коррозии металлов. Углекислота, кроме того, агрессивна по отношению к бетону. Свойство этих газов обусловливать и усиливать коррозийные процессы, а также неприятный запах, который сообщает воде сероводород, во многих случаях вызывают необходимость наиболее полного удаления их из воды.
Комплекс мероприятий, связанных с удалением из воды растворенных в ней газов, называется дегазацией воды.
Применяются химические и физические методы дегазаций воды.
Сущность первых заключается в использовании определенных реагентов, которые связывают растворенные в воде газы. Например, удаление из воды кислорода может быть достигнуто путем введения в нее сульфита натрия, сернистого газа или гидразина. Сульфит натрия при введении его в воду окисляется растворенным в воде кислородом до сульфата натрия:
2Na2SO3 + О2 -> 2Na2SO4.
В случае применения сернистого газа образуется сернистая кислота:
SO2 + Н2О -> H2SO3,
которая кислородом, растворенным в воде, окисляется до серной кислоты:
2H2SO3 + O2 -> H2SO4.
Химическим реагентом, при помощи которого удается достичь практически полного удаления из воды кислорода, является гидразин. При введении его в воду происходит связывание кислорода и выделение инертного азота:
N2H4 + O2-> 2H2O + N2.
Последний химический способ удаления из воды кислорода является наиболее совершенным, но вместе с тем и наиболее дорогим ввиду высокой стоимости гидразина. Поэтому этот способ применения в основном для окончательного удаления кислорода из воды после физических методов удаления кислорода.
Примером химического метода удаления из воды сероводорода может служить обработка воды хлором:
а) с окислением до серы:
H2S + Н2О -> S + 2HCl;
б) с окислением до сульфатов:
H2S + 4 Н2О -> H2SO4+ 8HCl
Эти реакции (так же как промежуточные реакции образования тиосульфатов и сульфитов) протекают параллельно в определенных соотношениях, зависящих в первую очередь от концентрации хлора и рН воды.
Химическим методам удаления газов из воды свойственны следующие недостатки:
а) необходимость применения реагентов, усложняющих и удорожающих процесс обработки воды;
б) возможность ухудшения качества воды при нарушении дозировки реагентов.
Вследствие этого химические методы удаления газов из воды применяются значительно реже физических.
Физические методы удаления из воды растворенных газов могут осуществляться двумя способами:
1) вода, содержащая удаляемый газ, приводится в соприкосновение с воздухом, если парциальное давление удаляемого газа в воздухе близко к нулю;
2) создаются условия, при которых растворимость газа в воде становится близкой к нулю.
При помощи первого способа, т. е. при помощи аэрации воды, обычно удаляются свободная углекислота и сероводород, поскольку парциальное давление этих газов в атмосферном воздухе близко к нулю.
Ко второму способу обычно приходится прибегать при удалении кислорода из воды, так как при значительном парциальном давлении кислорода в атмосферном воздухе аэрацией воды кислород из нее удалить нельзя. Для удаления из воды кислорода ее доводят до кипения, при котором растворимость всех газов в воде падает до нуля. Вода доводится до кипения либо ее нагреванием (термические деаэраторы), либо путем понижения давления до такого значения, при котором вода кипит при данной ее температуре (вакуумные дегазаторы).
Так что методов дегазации воды существует много. Относительно льда, то в настоящее время известно 14 структурных модификаций льда и возможно, в дальнейшем учёные откроют и другие модификации льда. Две последние модификации льда — XIII и XIV — открыли ученые из Оксфорда совсем недавно, в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре –160°С очень высока, и собраться вместе молекулам чистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Этого удалось достичь с помощью катализатора — соляной кислоты, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но они могут встречаться на замерзших спутниках других планет.
Табл. 3. — Некоторые данные о структурах модификаций льда
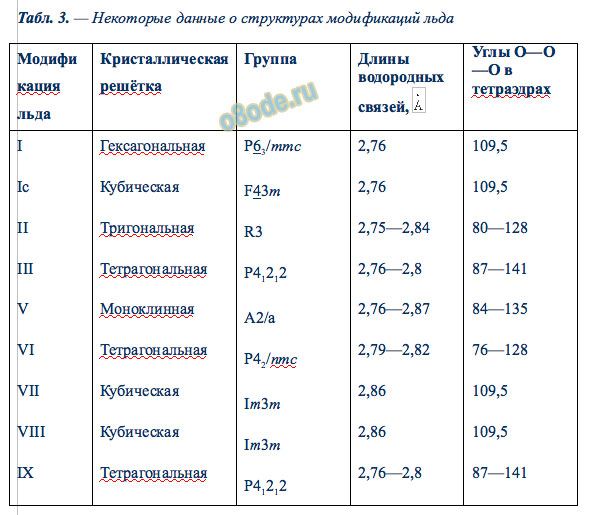
Среди модификаций льда есть и кристаллические (их большинство) и аморфные модификации, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Известен лёт и гексагональной, и кубической, и тригональной, и тетрагональной, моноклинной конфигурации. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной решётке, образуются в условиях экзотических — при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда. Но самое необычное свойство льда — это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки льда или гигантских ледниковых масс.
Разгадка структуры льда заключается в строении его молекулы. Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас. Молекулу воды можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В её центре находится атом кислорода, в двух вершинах — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, поэтому их называют неподеленными.
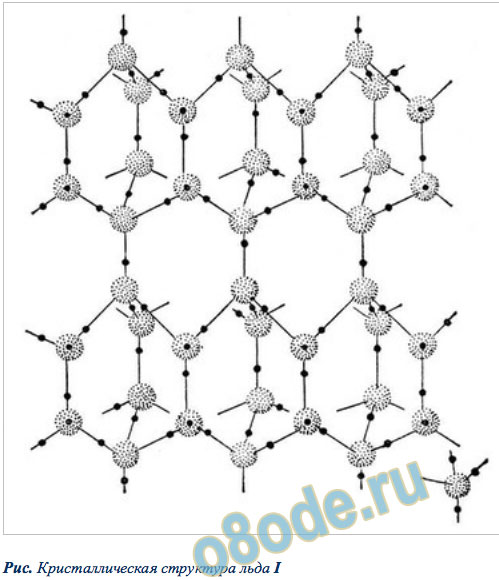
Рис. Структура льда.
Каждая молекула участвует в 4 таких связях, направленных к вершинам тетраэдра. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28', направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. При этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный. В структурах льда II, III, V и VI тетраэдры заметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы в виде сетчатой сетки, по структуре напоминающей соты с полыми каналами. Если лед нагреть, сетчатая структура разрушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, — поэтому вода тяжелее льда.
Следует признать, что самый обычный лед, который образуется при атмосферном давлении и плавится при 0 °С, — самое привычное, но всё же до конца не изученное вещество.
С уважением,
К.х.н. О.В. Мосин
Кажется, в таблице растворимости газов порядки величин перепутаны (должны быть отрицательными)
Thank You!
Сегодня вошло в практику использование живой и мёртвой воды, которую получают с помощью пропускания электричества через воду. Для чего подключают к двум проводам через мощный диод два графитовый электрода в сеть 220 вольт. Электроды, изолированные друг от друга, опускаются в трёхлитровую банку с водой. На аноде, который соединён с (+) диода, будут концентрироваться отрицательные ионы Н–, а на катоде ионы ОН+. На анод надевают сшитый из брезента стакан, в котором накапливается мёртвая вода. И хотя после открытия этого способа получения живой и мёртвой воды, был большой энтузиазм, что открыта панацея от всех бед организ ма, но оказалась, что полученная таким способом вода помогает далеко не от всех болезней. И причина этого кроется в том, что к электрической сети подключены тысячи телевизоров, сегодня однозначно несущих отрицательную информацию. Поэтому можно использовать любой автомобильный аккумулятор (уже без диода), и тогда получаемая вода, будет более эффективна, чем вода, полученная от сети. Живой водой считают щелочную воду имеющую рН 11 или 16 единиц, мёртвой кислую – с рН 4-5 единиц. Измерение проводится с помощью лакмусовой бумажки и по таблице цветов побежалости, которые продаются в химических магазинах вместе с набором лакмусовых бумажек, окончательно определяется кислотность. Древние получали живую и мёртвую воду практически таким же способом. Вспомните обнаруженные в Ираке и других местах кувшины с двумя металлическими пластинами, из железа и меди. При заливке воды в эти кувшины, между ними течёт ток. Его не хватит для освещения, но для получения живой и мёртвой воды вполне достаточно.
такая хороша статья
и такую дичь хулимудр прогнал, обалдеть
как заморозить лед побыстрее чтобы он был прозрачным, при этом с наименьшими затратами, лед технический для скульптур.
Сейчас это делается так лед морозится в течении 2-3 ех суток при этом вода до определенного момента прокачивается помпой, потом помпа убирается чтобы не вмерзла. Может как то можно при помощи химии недорогой размешал и заморозил в течении суток кристально прозрачный лед.
Как будет выглядеть вода без воздуха? Сможет ли она течь? По-моему вода без воздуха будет выглядеть как пена, сухая пена, либо как порошок. Позвольте процитировать ответ на то, как форму приняла вода в космическом вакууме: "В одном из полётов наших космонавтов ещё во времена СССР (год не помню) уже давно был сделан эксперимент - небольшой пакет с жидкой водой (не более 100г) вытолкнули в космос через люк и разорвали пакет струной, вставленной в пакет. Вода, попав в космос, мгновенно испарилась и образовала вокруг космического корабля большое ионизированное облако водяного пара, которое стало сопровождать корабль, начало светиться и нарушать радиосвязь с кораблём! Потом это облако постепенно рассеялось, и такие эксперименты решили больше никогда не повторять!
Всего доброго."