Отстаивание воды
Вопрос:
Однако у меня к вам, есть два вопроса. Воду я приготавливаю так: кипячу, резко охлаждаю, кладу на несколько дней 5-7 камешков кремня и отстаиваю, далее все как описано у вас, пропуская через магнит и употребляю. Вот тут у меня и появляется к вам вопрос: 1.Когда я отстаиваю воду в эмалированной или пластиковой посуде, вроде все нормально, однако стоит мне на 2-3 дня оставить ее в кастрюле из нержавейки, как на дне появляются какие-то белые сгустки, похожие на вареное яйцо, они сбиваются в комья. Когда посуду потрясти они распадаются на крошки. Так что это? Вячеслав
Ответ:
Уважаемый, Вячеслав!
Белые хлопья в воде обусловлены присутствием в воде значительного количества солей кальция, магния и железа – солей жесткости. Накипь и известковые отложения на бытовой технике (например, в чайниках), белые хлопья в воде, пленка на чае и т.д. - все это показатели жесткой воды. Использование такой воды для хозяйственных целей вызывает ряд неудобств.
Жёсткость воды сточки зрения химии — совокупность и физических процессов в воде, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Алюминий и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, "вклад" в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Жесткость воды во многом определяет пригодность воды для использования как промышленных, так и в бытовых целях. Возникновением накипи мы «благодарны» именно жесткой воде.
Жесткость воды принято исчислять суммой миллимолей ионов кальция и магния на 1 литр воды (ммоль/л). 1 ммоль/л соответствует количеству любого вещества в мг/л, равному его молекулярной массе, разделенной на валентность. Величина 1 ммоль/л говорит о содержании в 1 литре воды 20,04 мг/л кальция либо 12,10 мг/л магния. Для удобства пользуются величиной мг-экв/л, которая соответствует моль/м3. Кроме того, в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm карбоната кальция.
Выделяют два типа жесткости воды:
Временная – карбонатная жесткость, обусловлена присутствием в воде (при рН>8.3) бикарбонатов кальция и магния - Са(HCO3)2 и Mg(HCO3)2. При нагреве такой воды неустойчивые бикарбонаты снова переходят в нерастворимую форму – карбонаты - CaCO3↓, и MgCO3↓, образуется накипь (котельный камень). Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. кальция и магния. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов, соли кальция и магния которых (CaCl2, CaSO4, MgCl2, MgSO4) и при кипячении не устраняется (постоянная жесткость).
Общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости. По сути представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
По содержанию солей жёсткости принято классифицировать жесткость воды следующим образом:
мягкая вода – жесткость 3,0 мг-экв/л и более;
средняя жесткость – от 3,0 до 6,0 мг-экв/л;
жесткая вода – свыше 6,0 мг-экв/мл;
Жесткость воды колеблется в широких пределах и существует множество типов классификаций воды по степени ее жесткости. Ниже в таблице приведены четыре примера классификации. Две классификации из российских источников - из справочника "Гидрохимические показатели состояния окружающей среды" и учебника для вузов "Водоподготовка". Две - из зарубежных: нормы жесткости немецкого института стандартизации (DIN 19643) и классификация, принятая Агентством по охране окружающей среды США в 1986 г.
Таблица жёсткости воды
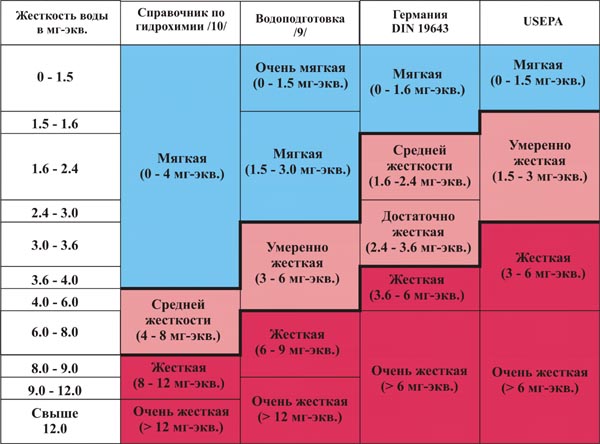
В природе причиной жесткости воды является подземные залежи известняков, гипса, доломитов, которые растворяются в подземных водах, а также отчасти, других процессов растворения и выветривания горных пород. Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость воды, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах - десятков граммов на один литр воды.
В целом, жесткость поверхностных вод меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах - десятков граммов на один литр воды.
Жесткость пресных природных водоемов меняется в течение года, имея минимум в период паводка. Например, в Москве, которую обслуживают четыре станции водоочистки, забор воды производится из Москвы-реки и из Волги (через канал им. Москвы), поэтому жесткость воды различна в разных районах Москвы но в среднем составляет ~ 5 мг-экв/л. Артезианская вода, как правило, более жесткая, чем из поверхностных источников. В Подмосковье, например, жесткость артезианских вод, меняется от 3 до 15-20 мг-экв/л в зависимости от места и глубины скважины.
Для некоторых областей применения воды жесткость не играет никакой роли. Например, при поливке газонов, тушении пожаров. Но, к сожалению, жесткость воды - это проблема не только воды для питья и приготовления пищи, но и воды, используемой в быту для стирки, мытья посуды и т. д. А для современной бытовой техники (стиральные, посудомоечные машины и т.д.), автономных систем горячего водоснабжения и отопления, новейших образцов сантехники – жесткость воды – катастрофа. Поэтому борьба с ней очень актуальна. Соли жесткости при нагревании выпадают в осадок, известный каждому как накипь, которая вызывает преждевременный выход из строя сантехники, бытовой техники, нагревательных котлов и труб. Потери от жесткости воды в быту – это перерасход на 30-50% моющих средств при стирке белья и купании, плохие потребительские свойства воды: при заваривании кофе или чая в такой воде может выпасть бурый осадок, при кипячении на поверхности образуется пленка, вода приобретает характерный привкус; в жесткой воде хуже разваривается мясо, потому что соли жесткости с белками мяса образуют нерастворимые соединения, что, в свою очередь приводит к снижению усвояемости белков. Необходимо отдельно остановиться на влиянии жесткости воды на результат умывания и купания. Соли жесткости образуют с моющими веществами (мыло, шампунь, стиральный порошок) так называемые “мыльные шлаки” в виде пены, которая, высыхая, образует микроскопическую корку на коже и волосах, нанося существенный вред их здоровью. В результате появляется сухость кожи, ломкость волос, шелушение, зуд, перхоть. Одним из предвестников такого нежелательного воздействия является характерный “скрип” вымытой кожи и волос. А восстанавливать жировую пленку приходится косметическими кремами и масками. И наоборот, ощущение “мылкости” после мытья мягкой водой – это признак сохранения на коже защитной жировой пленки. Косметологи всего мира рекомендуют умываться мягкой водой.
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка(накипи) на стенках котлов, в трубах и т. п. В тоже время, использование слишком мягкой воды может приводить к коррозии к как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость.
Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, хотя есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.
Приемлемость жесткости воды для питьевых нужд зависит от конкретных местных условий. Порог вкуса для иона кальция находится в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния - значительно ниже (в отдельных случаях приемлема вода жесткостью в 10 мг-экв/л). Жесткая вода имеет горьковатый вкус и негативно воздействует на органы пищеварения, органолептические свойства воды отвечают низкому уровню.
Однако мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость и может, в зависимости от значения рН и других параметров влиять на коррозионную активность водоводов (в данном случае повышать их устойчивость и работоспособность). В теплотехнике в некоторых случаях проводят специальную химическую подготовку воды с целью достижения оптимального и эффективного соотношения между жесткостью воды и ее коррозионной активностью.
В вашем случае выпадение белого осадка солей жёсткости на дне металлической кастрюли, по-видимому, обусловлено и высоким содержанием солей кальция и магния в используемой воде, так и магнитной обработкой воды, в результате которой происходит деформация гидратных оболочек растворённых в воде ионов металлов, изменяя тем самым их распределение в воде и растворимость.
Кроме того, магнитное поле, действуя на воду, может разрушать содержащиеся в ней коллоидные частицы: «осколки» образуют центры кристаллизации примесей, ускоряя их удаление. Наличие ионов железа интенсифицирует появление зародышей кристаллизации, что приводит к образованию непрочного осадка, выпадающего в виде осадка.
Также магнитное поле может оказывать воздействие непосредственно на структуру ассоциатов воды.
Питьевую воду очистить от солей жёсткости можно следующими способами:
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготвки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ.
Умягчение реагентами. Метод основан на добавлении в воду соды или гашёной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Ионный обмен. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na+-обмен и Н+-обмен. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.
Вы можете использовать обратный осмос для умягчения воды, т.е. перед тем как намагничивать её пропустить через обратно-осмотический фильтр.
В процессе обратного осмоса вода и растворенные в ней вещества разделяются на молекулярном уровне, при этом с одной стороны мембраны накапливается чистая вода, а все загрязнения остаются по другую ее сторону. Фактически же, в нормальных рабочих условиях, из входящей воды извлекается 98 – 99 % растворенных в ней минеральных веществ. В полученной в результате фильтрации чистой воде, остается 6 – 7 мг/л растворенных минеральных веществ.
Сегодня на российском рынке представлено несколько разновидностей фильтров мембранно-сорбционного класса. Они состоят из мембранного блока и одного-двух блоков (в зависимости от производительности и ресурса) дополнительной очистки. Кроме того, уже очищенная и стабилизированная по солевому составу питьевая вода проходит финишное 6-12-кратное осветление на специальных волокнах и сорбентах. Подобное сочетание многочисленных методов очистки и осветления жидкой среды, известное среди специалистов под названием «шлифовка воды», позволило довести ресурс данных водоочистителей до 50000-75000 л.
Отечественной промышленностью выпускаются и компактные обратноосмотические фильтры, предназначенные для очистки воды в походных или экстремальных условиях. Их основное достоинство - универсальность и компактность, их всегда можно взять с собой и иметь возможность воспользоваться фильтром в любой момент. Это телескопические трубки по форме и размерам с обычную авторучку. Несмотря на миниатюрность, подобные аппараты способны надежно очистить 10 л воды от бактерий, вирусов, хлора, фенола и токсичных металлов.
Но, несмотря на свои достоинства, осмотические фильтры нравятся не всем из-за того, что она бедна микроэлементами.
С уважением,
к.х.н. О.В. Мосин