Метод меченых атомов
О.В. МОСИН
Техника меченых атомов приобрела широкую популярность в наше время. Теоретически эта методика очень проста. По существу, она сводится к введению особого изотопа в биологически важный метаболит (или продукт питания), после чего прослеживаются последовательные реакции этого метаболита в организме путем наблюдения за судьбой меченого изотопа в продуктах распада, крови, моче и т.д. На основании этих данных строится метаболизм. Использование меченых изотопов стало возможным благодаря широкому развитию методов получения изотопов.
Большинство химических элементов в природных условиях существует в различных изотопных модификациях. Все изотопы данного химического элемента имеют одинаковые химические свойства, но разные атомные веса. Атомный вес изотопа равен сумме чисел нейтронов и протонов, находящихся в ядре. Химические свойства элемента определяются только числом протонов, т. е. атомным номером. (благодаря различию в атомных весах два изотопа элемента могут характеризоваться несколько различными скоростями реакции.) Например, изотопы углерода, такие, как С11, С12 и С13, имеют шесть протонов и соответственно 5, 6 и 7 нейтронов в ядре.
Некоторые природные изотопы радиоактивны; они испускают либо -частицы (ядра гелия Не4), либо отрицательные -лучи (быстрые электроны). Кроме того, многие радиоактивные изотопы испускают -излучение — фотоны высокой энергии.

Таблица (справа). Некоторые изотопы, используемые в биологии и химии.
Нерадиоактивные стабильные изотопы тоже могут быть использованы в методе меченых атомов, позволяя менять встречающиеся в природе изотопные соотношения. Содержание данного изотопа можно измерять с помощью масс-спектрометрической техники. Применяемые методы распространены на примере нерадиоактивного изотопа N15, который обычно встречается в концентрациях много меньших, чем N14. Вводя соединения с высоким содержанием N15, можно приготовить образцы метаболитов с избытком данного изотопа.
Обычно радиоактивный элемент используют в виде примеси в растворе — носителе, например радиоактивный С14 используют растворенным в избытке нерадиоактивного С12. Такие соединения могут быть тогда применены в системах, которые находятся в полном термодинамическом равновесии относительно атомов углерода, но далеких от равновесия относительно меченого изотопа. Метод меченых атомов позволяет изучать равновесные биологические процессы без нарушения химического равновесия.
МЕЧЕНЫЕ АТОМЫ
В ходе эксперимента радиоактивные атомы распадаются. Распад данного атома представляет собой случайное событие; число распадов в секунду пропорционально числу радиоактивных атомов, существующих в настоящий момент. В аналитической форме сказанное записывается в виде
dN/dt = -N; (1)
где N — число радиоактивных атомов, существующих в данное время, t — время, N, — постоянная, характерная для выбранного изотопа. Интегрируя уравнение (1), получаем
N = N0e-t (2)
где N0 — число .радиоактивных атомов в начальный момент. Из формулы (2) может быть определено время т, за которое число N уменьшается вдвое:
= ln2/ (3)
Время называют периодом полураспада элемента. В течение каждого периода полураспада число атомов изотопа уменьшается в два раза.
Чтобы изотоп можно было использовать, применяя метод меченых атомов, должно быть в разумных пределах. Если слишком мало (порядка секунд), то изотоп распадется до того, как можно будет поставить большинство экспериментов. Но если слишком велико, то число распадов за 1 сек получится недопустимо низким для обнаружения обычно употребляемых концентраций меченых атомов. Изотоп С14 с периодом полураспада 5700 лет находится близко от этого нижнего предела.
Активность образцов радиоактивного материала выражают числом распадов в секунду. Число распадов, происходящих в 1 г радия за 1 сек, равное 3,7-1010, называют кюри. Для биологических исследований с помощью меченых атомов наиболее удобно использовать одну тысячную этой единицы, т. е. милликюри. Число атомов на 1 мкюри связано с периодом полураспада. Если имеется 1 кюри данного радиоактивного изотопа, то
N = /ln2 x З,7-107 атомов.
Радиоактивные изотопы идентифицируют по их характеристическому излучению. В случае искусственных радиоактивных изотопов оно обычно складывается из -лучей и из -излучения. В случае орбитального электронного захвата (когда один из электронов поглощается ядром с уменьшением атомного номера на единицу) испускаются лишь фотоны. Характеристикой излучения данного изотопа является максимальная энергия -лучей и энергия -излучения (фотонов). Удобными единицами измерения при этом являются электрон-вольты (эв), килоэлектрон-вольты (кэв) или мегаэлектрон-вольты (Мэв); 1 эв — это энергия, приобретаемая электроном в результате прохождения ускоряющей разности потенциалов в 1 в2).
Частицы, испускаемые в результате радиоактивного распада, обнаруживаются при помощи специального детектора излучения. Его показания могут быть затем подсчитаны с помощью любой электронной схемы. В прошлом наиболее широко распространенным типом детектора была трубка Гейгера — Мюллера, называемая счетчиком Гейгера. Он состоит из цилиндрической камеры, наполненной газом, с натянутой по ее оси проволокой (рис. 1). Проволока изолирована от внешнего цилиндра и находится под высоким потенциалом. Ионизирующие частицы, попадая в счетчик, вызывают лавинную ионизацию в газе; если к счетчику приложена достаточно высокая разность потенциалов, возникающий импульс ионизационного тока будет зарегистрирован.
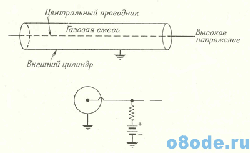
В конструкции счётчиков Гейгера применяются трубки различного диаметра – от нескольких миллиметров до 25 см. Длина трубки колеблется от 1 до 50 см. Газ, наполняющий счетчик, геометрия приборов и чистота материала стенок — все это влияет на работу счетчика. Импульсы счетчика Гейгера считают при помощи электронных схем. Обычно показания снимают с групп светодиодов, с электронного табло или с бумажной ленты. Другие электронные схемы позволяют осуществлять непосредственный счет импульсов.
Другим типом детектора радиоактивного излучения является сцинтилляционный счетчик. Принцип работы этого счетчика основан на использовании мельчайших вспышек света, образующихся при попадании ионизирующего излучения во многие типы кристаллов и жидкостей. Спектральный состав излучения этих вспышек характерен для данного сцинтиллятора. Интенсивность сцинтилляционных вспышек пропорциональна энергии, израсходованной частицей. Сцинтилляцию в свою очередь обнаруживают с помощью фотоумножителя, выходной сигнал которого поступает на амплитудный анализатор. Таким образом, определенный изотоп может быть выделен из смеси или на фоне «шумов».
Сцинтилляционные счетчики могут быть изготовлены различных размеров и формы. Пропорциональность выходного сигнала энергии частицы в этом случае более строгая, чем для газового пропорционального счетчика. Применение жидкостных сцинтилляционных счетчиков позволяет растворять образцы, имеющие низкую интенсивность или же низкую энергию излучения, так как в этом случае для регистрации используется излучение, испускаемое во всех направлениях. Для обнаружения -излучения сцинтилляционные счетчики более эффективны, чем счетчики Гейгера. Однако в определенных случаях счетчики Гейгера имеют несколько лучшее отношение сигнала к шуму, чем большинство других сцинтилляционных счетчиков.
В некоторых случаях не так важно точно знать скорость распада, как выяснить, в какой части клетки локализован изотоп. Аналогичная задача возникает в бумажной хроматографии, когда различные соединения распределяются на поверхности куска фильтровальной бумаги. Далее желательно найти на бумаге распределение радиоактивных участков. Чтобы их обнаружить, можно поместить срез ткани (или фильтровальную бумагу) на куске фотобумаги. Она будет засвечена излучением, а затем при проявлении позволит определить локализацию радиоактивных изотопов. Такой снимок называют радиоавтографом.
Любой из этих методов регистрации может быть использован для любого изотопа. Хотя известно существование радиоактивных изотопов для всех элементов, в биологических исследованиях используют лишь ограниченное их число. К наиболее известным относятся С14, J131 и Р32.
ИЗОТОП УГЛЕРОДА С14
Встречающийся в природе углерод почти полностью состоит из стабильного изотопа С12. Кроме того, всегда имеется немного (около 1%) стабильного изотопа С13 и ничтожное количество радиоактивного изотопа С14. Искусственным путем можно получить изотоп С14, а также радиоактивные изотопы С10 и С11. Изотопы С10 и С11 имеют период полураспада соответственно 19 сек и 20,5 мин; при распаде оба изотопа испускают положительные -лучи и образуют изотопы бериллия (Be). Их периоды полураспада настолько коротки, что в биологических исследованиях с использованием меченых атомов применяют лишь радиоактивный изотоп углерода С14. Так как углерод является существенной частью всех биологических соединений, то изотоп С14 используется очень широко. Получить изотоп С14 можно с помощью ряда реакций. Если углерод, обогащенный изотопом С13, бомбардировать нейтронами, то некоторая его часть превращается в С14 за счёт реакции.
C13 + n 1 ------C14 +
Если углерод, обогащенный С13, бомбардировать дейтронами, то образуется С14:
C13 + D ------C14 + H1
Ни одну из этих реакций нельзя считать удобной, так как для концентрации С13, а затем и С14 должен быть использован масс-спектрометр.
Наиболее эффективная реакция получения изотопа С14 состоит в бомбардировке N14 нейтронами:
N14 + n1 ------C14 + H1
Соединения нитрат аммония (NH4NO3) и нитрит бериллия (BeNO2) часто используют как источники азота. Затем изотоп С14 может быть выделен стандартными электрохимическими методами. Некоторое количество его образуется таким способом в результате действия космических лучей на N14 в атмосфере, что дает около 10 отсчетов в 1 мин на 1 г углерода, находящийся в равновесии с атмосферным СО2.
Период полураспада С14 составляет около 5760 лет. Поэтоиу, для получения измеримого числа отсчетов необходима высокая концентрация этого изотопа. При распаде С14 испускает только электроны и превращается в N14; испускание -излучения отсутствует. Максимальная энергия электронов составляет примерно 0, 154 Мэв. Эта величина сравнима с энергией фотонов, излучаемых медицинской рентгеновской трубкой, и меньше энергии частиц многих других радиоактивных изотопов. Применяются различные способы регистрации этих электронов. Иногда образец, содержащий С14, заделывают в таблетку карбоната бария (ВаСО3) и помещают внутри счетчика Гейгера. Разработаны специальные счетчики Гейгера, предназначенные для наполнения их изотопом С14 в виде газа 14СО2. Используются также различные жидкие сцинтилляторы . Во всех случаях образец не должен быть очень толстым, так как все испускаемые им -лучи поглощаются при прохождении через несколько миллиметров твердого или жидкого вещества образца.
Изотоп С14 имеет большое значение при проведении исследований. Изучение синтеза протопорфирина и определение возраста органических веществ при помощи углерода — два характерных примера использования изотопа С14.
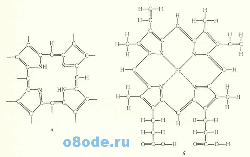
Рис. 2. Основная порфириновая структура (а) и железопротопорфирин IX (б).
Основная порфириновая структура представляет собой простетическую группу, общую для гемоглобина, миоглобина, каталазы, пероксидазы и цитохромов. Была также найдена в хлорофилле. К восьми «свободным» связям присоединяются различные группы. Железопорфирин IX (основная часть многих геминовых белков) содержится в составе гемоглобина, миоглобина и каталазы. Другие геминовые белки несут либо эту порфириновую структуру, либо ее производное, образованное простыми заменами. Атом железа находится в закисной форме в восстановленном и оксигемоглобине, а также в восстановленном и оксимиоглобине. В пероксидазе железо находится в окисном состоянии. У других геминовых белков атом железа в продолжение реакции может поочерёдно восстанавливаться и окисляться.
С помощью ряда экспериментов показано, что при образовании протопорфирина используется аминокислота глицин. Соответственно этому было приготовлено две формы глицина (звездочкой обозначен меченый атом, в данном случае С14).
При использовании первой модификации было найдено, что радиоактивность включается в порфириновое кольцо, тогда как при использовании второй формы этот эффект не обнаруживался. Эти эксперименты показали, что глицин участвует в биосинтезе протопорфирина, но что углерод карбоксильной группы [СООН] с синтезом не связан. Хотя этот пример кажется очень простым, было бы невозможно выяснить роль глицина каким-либо иным методом, кроме использования меченых атомов. Опыты с изотопом N1B также указывают на то, что глицин является предшественником протопорфирина.
Ярким примером использования меченых атомов может служить определение геологического возраста с помощью углерода. В этом случае измеряется радиоактивность древесины или других органических материалов. Если эти материалы составляют часть системы недавно бывшей живой, то ее атомы углерода будут находиться в динамическом равновесии с СО2 атмосферы; в результате за счет изотопа С14 космического происхождения образец будет давать около 10 отсчетов в 1 мин на 1 г углерода. В таком же веществе, но уже в течение долгого времени не живом и, следовательно, не находящемся в равновесии с СО2 атмосферы, изотоп С14 постепенно распадается и не восстанавливается. Таким образом, следует ожидать, что кусок кости мамонта, имеющей возраст около 5760 лет, содержит в два раза меньше С14 на 1 г углерода по сравнению с недавно возникшим живым материалом. А кусок древесины в возрасте 11 500 лет должен содержать в четыре раза меньше этого же количества (т. е. давать 2,5 отсчета в 1 мин на 1 г углерода). Благодаря изотопу С14 возникает слабая радиоактивность с невысокой интенсивностью. Тем не менее можно очень точно измерить содержание С14, должным образом отделив отсчеты, возникающие за счет космических лучей, распада другого рода, радиоактивного фона комнаты и электронных шумов. Когда удается сравнить данные, полученные с помощью С14, сданными, полученными каким-либо другим способом, то обнаруживается, что они согласуются друг с другом в пределах экспериментальной ошибки. Для объектов, содержащих углерод и имеющих возраст от 2000 до 50 000 лет, данные, полученные с помощью изотопа С14, могут быть вычислены более точно, чем с помощью любых других методов. Возраст многих объектов, имеющих значение для археологии, антропологии и эволюции, можно определить только с помощью изотопа С14.
ИЗОТОП ЙОДА J131
Стабильный йод, встречающийся в природе, состоит главным образом из изотопа J127. Известны многие радиоактивные изотопы йода: J128, J129, J130 и J131. Период полураспада изотопа J128 равен 25 мин, а изотопа J130—12 час. Оба названных изотопа используют в биологических исследованиях, но для большинства экспериментов они слишком короткоживущие. Изотоп J129 имеет период полураспада около 107 лет, что слишком много для успешного его применения в качестве радиоактивного индикатора. Очень удобную продолжительность жизни (8 дней) имеет изотоп J131, обладающий много более высокой скоростью распада на грамм-атом, чем изотоп С14. В течение нескольких месяцев изотоп J131 почти полностью распадается и уже не представляет вреда для здоровья. Вследствие его короткого периода полураспада количество полученных отсчетов всегда надо рассматривать как функцию той части первоначального количества, которая еще не распалась.
При распаде изотоп J131 испускает много частиц: электроны с максимальной энергией 0,6 и 0,3 Мэв, а также -кванты с энергией 0,08, 0,28, 0,37 и 0,64 Мэв. Два последних типа -излучения легко проходят через ткани и алюминиевые фольги и могут быть свободно обнаружены. Окружив детектор металлическим экраном, можно понизить естественный фон, не снижая чрезмерно чувствительность к -излучению.
Изотоп J131 можно получить, бомбардируя J130 нейтронами. Более удобный метод заключается в бомбардировке нейтронами изотопа Те130. Этим способом получают J131, который может быть выделен с большой степенью чистоты среди всех других элементов. Основное количество изотопа J131 получают из продуктов деления. Для использования в биологических исследованиях изотоп J131 обычно превращают в йодид какого-либо металла.
Для позвоночных йод является важным метаболитом, так как он составляет часть гормонов щитовидной железы. Его концентрация в щитовидной железе в 10 000 раз больше, чем в любом другом органе. Человеку ежедневно необходимо лишь очень малое количество йода (приблизительно 100 мкг). Если, однако, он содержится в пище в меньшем количестве, то у человека возникают различные заболевания щитовидной железы.
Радиоактивный Jl3l используют для того, чтобы проследить прохождение йода, начиная с момента его заглатывания, попадания в щитовидную железу, распределения в гормонах, по всему организму и до окончательного выделения. Особенно важным примером является изучение поглощения щитовидной железой йода, введенного внутривенно. До использования изотопа было невозможно продемонстрировать протекание этого процесса у человека.
Проведены эксперименты, в которых различные количества изотопа J131 были введены морским свинкам, крысам, собакам и людям. В любом случае при небольших инъекциях йодида большая его часть, а иногда даже все введенное количество .в течение 24 час концентрировалось в щитовидной железе. При высоких «фармакологических» дозах (около 5 ms. J131 на 1 кг живого веса) щитовидная железа концентрирует небольшую часть введенного йодида в течение первых 5 мин, после чего наступает насыщение. Содержание организма на сверхвысокой йодной диете также вызывает насыщение щитовидной железы. Эксперименты с применением ингибиторов показывают, что железа концентрирует йодид как таковой, даже если у нее подавлено образование ди-йодо-тирозина и тироксина. С помощью этих экспериментов показано, что щитовидная железа людей, питающихся нормальной пищей, не насыщена йодом, но в состоянии поглотить его в относительно громадных концентрациях (по крайней мере 500 : 1 для йодидового коэффициента кровь/щитовидная железа),
ИЗОТОП ФОСФОРА Р32
Фосфор — это важнейшая составная часть всякого живого организма. Он является существенным элементом нуклеиновых кислот, которые переносят генетическую информацию и определяют синтез белков. Живые клетки используют фосфор в АТФ (аденозинтрифосфате) — соединении, которое является хранилищем энергии. Он играет важную роль во многих окислительных и восстановительных процессах. Фосфат кальция является основной составляющей частью костей. В природе фосфор существует только в виде Р31. Он имеет биологически важный изотоп Р32. Его получают на ядерных реакторах из серы с помощью реакции
S32 + n1 ------H32 + H1
Изотоп Р32 имеет период полураспада 14,3 дня. Как и J131, он удобен в применении, потому что его период полураспада достаточно велик, что позволяет проводить с этим изотопом эксперименты, но в то же время он достаточно мал, что обеспечивает легко измеряемую интенсивность распада. Как изотоп С14, так и изотоп Р32 испускают электроны. Электроны, испускаемые изотопом С14, сравнительно трудно обнаружить, так как их максимальная энергия составляет только около 0,15 Мэв; максимальная энергия электронов, испускаемых изотопом Р32, равна 1,7 Мэв, поэтому они обнаруживаются очень легко.
Радиоактивные атомы изотопа Р32 использовались для изучения скорости синтеза дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК). В ткани мозга в течение одного дня заново возникает менее 1% ДНК, в ткани печени — приблизительно 1 %, а в мукозе тонких кишок — до 15%. Это свидетельствует о том, что в клетках, которые не размножаются быстро, происходит сравнительно малый обмен ДНК. В эмбриональной и раковой тканях скорость восстановления (или синтезирования заново) ДНК даже выше, чем в мукозе тонких кишок. Эти данные, между прочим, непосредственно указывают на связь ДНК с генетической информацией.
РНК синтезируется значительно быстрее ДНК во всех тканях, за исключением быстро растущих. Хотя скорость синтеза РНК несколько выше в мукозе тонких кишок, чем в печени, они различаются в этом случае лишь в 2—3 раза, тогда как разница между скоростями синтезов ДНК достигает 15 раз. Эти данные находятся в Согласии с представлением о том, что РНК не несет прямой ответственности за передачу генетической информации.
СТАБИЛЬНЫЕ ИЗОТОПЫ
В качестве меченых атомов, кроме радиоактивных, могут быть использованы и редкие стабильные изотопы. Для измерения относительной распространенности стабильных изотопов используют масс-спектрометр (рис. 3).
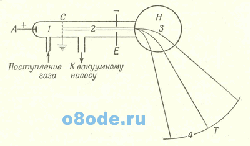
1 – ионизационная камера; 2 – область ускорения; 3 – магнитный спектрометр скоростей; 4 – детектор; А – анод; С – катод с отверстием; Е – электрод, находящийся под высоким отрицательным потенциалом; H – магнитное поле; T – мишень.
При масс-спектрометрическом анализе исследуемый материал сначала должен быть превращен в летучий газ, который затем подается при низком давлении в зону, где его бомбардируют электронами; это происходит в ионизационной камере (область 1 на рис. 3). Бомбардировка электронами приводит к выбиванию валентных электронов из атомов, которые, таким образом, превращаются в положительные ионы. Эти положительные ионы, если давление газа достаточно низкое, ускоряются по направлению к катоду. Они проходят через отверстие в катоде и ускоряются высоким напряжением между катодом и электродом А (рис. 3). Все однозарядные ионы приобретают одинаковую кинетическую энергию Е:
E = ½ mv2
Скорость же ионов различна для каждого изотопа. Затем ионы разделяются в соответствии с величиной скорости путем отклонения в магнитном поле или с помощью других средств и окончательно масс-спектрометр может, быть использован для разделения изотопов или для определения концентрации изотопов. Масс-спектрометр больше и сложнее сцинтилляционного счетчика, но в принципе его использование не вносит дополнительных проблем.
ИЗОТОП АЗОТА N15
Азот N15 содержится во всех живых организмах, он найден во многих строительных блоках — биологических полимерах, таких, как аминокислоты, пурины, пиримидины, порфирины и флавины. Аминокислоты являются единицами, из которых полимеризуются белки; таким образом, все белки содержат азот. Точно так же нуклеиновые кислоты, ДНК и РНК содержат пурины и пиримидины, а следовательно, и азот.
Встречающийся в природе азот состоит из изотопов N14 (99,64%) и N16 (0,36%). Поскольку природная распространенность изотопа N15 так низка, он чрезвычайно подходит для исследований с использованием стабильных изотопов. Долгоживущий радиоактивный изотоп N13 имеет период полураспада только 10 мин, поэтому его можно использовать лишь в ограниченном числе экспериментов. Изотоп N16 является единственным, который применяется в большинстве биологических исследований, использующих азот для метода меченых атомов.
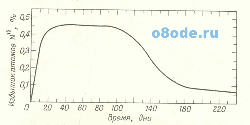
Рис. 4. Эксперимент с меченными атомами гемоглобина эритроцитов человека. Фиксируется излишек изотопа N15 в геминовой группе эритроцитов человека, получавшего в течение 3 дней меченый N15 глицин (рис. Из книги Ю. Аккермана Биофизика, М., Мир, 1964).
При этих исследованиях подвергавшихся эксперименту людей кормили в течение 3 дней глицином, меченным N15 (рис. 4). При этом избыток N15 быстро встраивался в геминовую группу эритроцитов. Эти данные использовались для определения скорости «рождения» новых клеток. Используя этот график, исследователи высчитали среднее время жизни эритроцитов человека, которая равна приблизительно 127 дням.
Таким образом, в методе меченых атомов необычные изотопы используются многими разнообразными способами. Возможности использования определённых меченых атомов зависят от их доступности, периода полураспада, энергии продуктов распада, наличия подходящего для регистрации оборудования и концентрации элемента в живой системе.
ЛИТЕРАТУРА
Advances in Biological and Medical Physics, ed. by J. H. Lawrence and,
J. G. Hamilton, New York, Vol. 1, 1948; Vol. 2, 1951.
Advances in Biological and Medical Physics, ed. by J. H, Lawrence and
C. A. Tobias, New York, Vol. 3, 1953.
А г n о f f S., Techniques of Radmbiochemistry, Ames, Iowa, 1956.
Co mar C. L., Radioisotopes in Biology and Agriculture: Principles
and Practice, New York, 1955.
К a m e n M. D., Radioactive Tracers in Biology, 2nd ed., New York, 1951.
Strominger D., Hollander J. D., S e a b о г g G. Т., «Table
of Isotopes», Rev. Mod. Phys., 30, 42, Pt. II, 585 (1958).