Условия первичной гидросферы в процессе происхождения органических форм жизни в горячей минеральной воде
Авторы:
© Игнатов И., Мосин О.В.
Перепечатка только с согласия авторов.
В статье обсуждается изотопный состав первичной водной среды, ее температура и показатель pH в экспериментах по моделированию условий первичной гидросферы и происхождения первых органических форм жизни в горячей минеральной воде. Рассмотрен синтез органических молекул аминокислот, протеинов, нуклеиновых кислот и термических микросфер-протеиноидов из неорганических молекул, а также возможные реакции, протекающие в первичной водной гидросфере с показателем pH = 9…10 в условиях повышенных температур. Методом ИК-спектроскопии (ДНЭС-метод) исследованы образцы горячей минеральной, морской и горной воды из различных термальных источников Болгарии. Показано, что щелочная минеральная вода с температурой от +65 0C до +95 0C и значением показателя pH от 9 до 11 является более подходящей для возникновения органических форм жизни, чем другие исследованные образцы воды. Значение показателя кислотности морской воды ограничено значениями pH от 7,5 до 8,4 единиц. Высказано предположение, что в первичной гидросфере мог накапливаться дейтерий в форме HDO.
Введение
Природная распространённость дейтерия (D) составляет 0,015…0,020 атом.% D [1]. Источником дейтерия во Вселенной являются вспышки сверхновых звёзд и термоядерные процессы, идущие внутри звёзд. Возможно, этим объясняется тот факт, что мировое количество дейтерия повышается в период глобальных потеплений и изменений климата. Гравитационное поле Земли недостаточно сильное для удержания лёгкого водорода, и наша планета постепенно теряет водород в результате его диссоциации в межпланетное пространство. Водород улетучивается быстрее тяжелого дейтерия, способного накапливаться в земной гидросфере. Поэтому в результате этого природного процесса фракционирования изотопов H/D в процессе земной эволюции должно происходить накопление дейтерия в поверхностных водах, в то время как в атмосфере и в водяном паре содержание дейтерия низкое. Таким образом, на планете происходит масштабный природный процесс разделения изотопов H и D, играющий существенный роль в поддержании жизни.
Сотношение D/H (изотопные сдвиги, δ, ppm) по международному стандарту SMOW, соответствующему стабильной по изотопному составу воде Мирового океана, составляет: D/H = (155,76±0,05).10−6 (155,76 ppm) [2]. По международному стандарту природной воды из Антарктики SLAP с самым низким содержанием дейтерия, соотношение D/H в воде составляет D/H = 89.10−6 (89 ppm). Для природных вод чаще всего характерны отрицательные отклонения от SMOW на (1,0…1,5).10-5, в отдельных случаях до (6,0…6,7).10-5, но встречаются и положительные отклонения до 2,0.10-5. В среднем в природных водах соотношение D/H составляет 1:5700. Дейтерий в природных водах распределен неравномерно: варьируя от 0,015 атом.% D для воды из Антарктического льда, до 0,02…0,03 атом.% D для речной и морской воды. Талая вода и горная вода, полученная за счет таяния ледников содержит на ~3…5 % меньше дейтерия, чем речная вода. В среднем, в 1 тонне речной воды содержится ~150…300 г. дейтерия. Воды других подземных и поверхностных источников содержат разное количество дейтерия от δ = +5,0 D,%, SMOW (Средиземное море) до to δ = –105 D,%, SMOW (река Волга).
Исследования, проведенные авторами раннее, свидетельствуют о том, что первичная вода на ранних стадиях эволюции содержала больше дейтерия, и он был распространен неравномерно в атмосфере и гидросфере [3]. Как известно, первичная атмосфера Земли обладала восстановительными свойствами и состояла, в основном, из смеси газов — CO, Н2, N2, NH3 и CH4. В условиях восстановительной атмосферы отсутствовал защитный кислородно-озоновый слой, экранировующий поверхность Земли от жесткого коротковолнового солнечного излучения, несущего большую энергию, способного вызвать фотолиз и радиолиз воды. Процессами, сопровождающими накопление дейтерия в гидросфере признаны радиационное излучение, вулканические геотермальные процессы и электрические разряды в атмосфере. Эти природные процессы могли явиться результатом обогащения гидросферы дейтерием в форме полутяжелой воды
— HDO, которая испаряется медленнее обычной воды, а конденсируется быстрее. Формирование НDO происходит в смесях D2O–H2O за счет реакций диссоциации и изотопного (H–D) обмена: H2O + D2O = 2HDO. Поэтому при низких концентрациях дейтерий присутствует в воде в форме HDO, а при высоких — в форме D2O. Строение молекул D2O такое же, как молекул Н2O, с очень малым различием в значениях длин ковалентных связей и углов между ними. D2O кипит при 101,44 0С, замерзает при 3,82 0С, имеет плотность при 20 0С 1,1053 г/см3, причём максимум плотности приходится не на 4 0С, как у Н2O, а на 11,2 0С (1,1060 г/см3). Эти эффекты отражаются на энергии химической связи, кинетике и скорости химических реакций в D2O. Протолитические реакции и биохимические процессы в D2O значительно замедлены. Однако, существуют и такие реакции, скорость которых в D2O выше, чем в Н2O. В основном это реакции, катализируемые ионами D3О+ или H3О+ или OD- и ОН-. Согласно теории абсолютных скоростей разрыв С–H-связей может происходить быстрее, чем С–D-связей, подвижность иона D3О+ меньше, чем подвижность Н3О+, константа ионизации D2O меньше константы ионизации H2O. Это означает, что в первичной воде самоорганизующиеся дейтерированные структуры могли существовать дольше во времени, чем протонированные формы. Стабилизирующее воздействие D2O на химические связи из-за изотопных эффектов D несколько более выражены, чем у H2O [4]. Самые большие изотопные эффекты в разнице констант скоростей химических реакций с соотношением kh/kd = 6…8 наблюдаются в D2O для C–H/C–D, N–H/N–D и O–H/O–D связей [5].
Дейтерированные клетки различных микроорганизмов, адаптированные к максимальным концентрациям D2O в ростовых средах (95…98 атом.% D) являются удобными объектами для прогнозирования условий эволюции и адаптации, а также изучения структуры и конформации клеточных природных соединений и молекулярной организации клетки методом ЯМР-спектроскопии. В процессе роста в D2O в клетках синтезируются молекулы протеинов и ДНК, атомы водорода в углеродных скелетах которых почти полностью замещены на дейтерий. Такие дейтерированные макромолекулы претерпевают структурно-конформационные изменения, необходимые для их функционирования в D2O.
Интерес к дальнейшему использованию дейтерированных клеток микроорганизмов в исследованиях на их основе механизмов клеточной адаптации к D2O и молекулярной эволюции, предопределил направление наших исследований. Целью настоящей работы являлось изучение изотопных эффектов дейтерия в биологических системах с D2O и моделирование условий первичной гидросферы (температура, показатель кислотности рН, изотопный состав), в которых образовались первые органические формы жизни.
Экспериментальная часть
Материалы и методика эксперимента
Исследования проводились с клетками прокариот и эукариот, реализующими метилотрофный (облигантые и факультативные метилотрофные бактерии — Brevibacterium methylicum, Methylobacillus flagellatum), хемогетеротрофный (Bacillus subtilis), фотоорганотрофный (галобактерия Halobacterium halobium) и фотосинтетический (сине-зеленая водоросль Chlorella vulgaris) пути ассимиляции субстратов, а также с образцами воды различного происхождения (Болгария).
Образцы воды для их исследования методом ИК-спектроскопии (ДНЭС-метод) были взяты из различных источников Болгарии:
- минеральная вода местечка Рупит (Болгария);
- морская вода (курорт Варна, Болгария);
- горная вода (Тетевен, Болгария).
В качестве модельной системы использовался сок кактуса Echinopsis pachanoi.
Для приготовления ростовых сред использовали D2O (99,8 атом.% D), DСl (95,5 атом.% D) и дейтеро-метанол (97,5 атом.% D), полученные из Российского научно-исследовательского центра Изотоп
(Санкт-Петербург, РФ). Неорганические соли предварительно перекристаллизовывали в D2О, D2O дистиллировали над KMnO4 с последующим контролем изотопной чистоты 1Н ЯМР-спектроскопией на приборе Brucker WM-250 (Brucker, Германия) (рабочая частота — 70 МГц, внутренний стандарт — Me4Si).
Для выращивания клеток и изучения адаптации использовали жидкие и твердые (2 % агар) ростовые среды со ступенчато увеличивающейся концентрацией дейтерия в них (от 0; 24,5; 49,0; 73,5 до 98 % D2O). Выращивание метилотрофов и хемогетеротрофов проводили при температуре +34…35 0С в колбах Эрленмейера вместимостью 500 мл с наполнением средой до 100 мл в условиях интенсивной аэрации в орбитальном шейкере 380-S (Biorad, Венгрия), используя в качестве источников дейтерия D2O и дейтеро-метанол. Фотоорганотрофы и сине-зеленые водоросли выращивали при температуре +38 0С и интенсивном освещении лампами дневного света ЛДС-40-2 (40 Вт) (ООО Альфа-Электро
, Россия). Клеточный рост определяли по способности к образованию отдельных колоний на поверхности твердых агаризованных (2 % агар) сред, а также по величине оптической плотности суспензии клеток, измеренной на спектрофотометре Beckman DU-6 (Beckman Coulter, США) при длине волны λ = 620 нм.
Уровни включения дейтерия определяли на импульсном масс-спектрометре VG-70 SEQ (Fisons VG Analytical, США), снабженным цезиевым источником Cs+ на глицериновой матрице с ускоряющим напряжением 5 кВ и ионным током 0,6…0,8 мА и 1Н ЯМР-спектроскопией на приборе Brucker WM-250 (Brucker, Германия) (рабочая частота — 70 МГц, внутренний стандарт — Me4Si).
ИК-спектры образцов воды регистрировали на ИК-спектрометре Brucker Vertex (Brucker, Германия) (спектральный диапазон: средний ИК — 370…7800 см-1; видимый — 2500…8000 см-1; разрешение — 0,5 см-1; точность волнового числа — 0,1 см-1) и Фурье ИК-спектрометре Thermo Nicolet Avatar 360 (Nicolet Thermo Scientific, США) методом дифференциального неравновесного энергетического спектра (ДНЭС).
Статистическую обработку экспериментальных данных проводили с помощью программы статистического пакета STATISTIСA 6, используя критерий t-Стьюдента (при р < 0,05).
Результаты и обсуждение
Мы исследовали изотопные эффекты дейтерия в прокариотических и эукариотических клетках различных таксономических групп микроорганизмов, реализующих метилотрофный, хемогетеротрофный, фотоорганотрофный и фотосинтетический пути ассимиляции субстратов (облигантые и факультативные метилотрофные бактерии, хемогетеротрофные бактерии, галобактерии, синезеленые водоросли) методами 1Н ЯМР-, ИК- и масс спектрометрии. Адаптацию клеток к дейтерию проводили согласно разработанному методу ступенчатой адаптации за счет рассева исходных клеток на твердые (2 % агар) питательные среды при ступенчатом увеличении градиента концентрации дейтерия в них (от 0; 24,5; 49,0; 73,5 до 98 % D2O) и последующей селекции устойчивых к воздействию дейтерия клеток. Стратегия адаптации клеток к дейтерию показана в таблице 1 на примере метилотрофной бактерии B. methylicum. Выросшие на средах с низким градиентом концентрации D2О клетки последовательно переносили на среды с большим градиентом концентрации, вплоть до 98 % D2О. В результате на максимально дейтерированных средах с 98 % D2О получены адаптированные к дейтерию клетки, весь биологический материал которых вместо водорода содержит дейтерий. Уровень выживаемости клеток на максимально дейтерированной среде составил не более 40 %.
Таблица 1
Изотопный состав ростовых сред и характеристики роста метилотрофных бактерий B. methylicum в процессе адаптации к дейтерию*
- Номер опыта; Компоненты среды, об.%; Лаг-период, ч; Выход биомассы, % от контроля; Время клеточной генерации, ч
- H2O; D2O
- 1; 98,0; 0; 20,3±1,40; 200,2±3,20; 2,2±0,20
- 2; 73,5; 24,5; 34,2±0,89; 171,8±1,81; 2,6±0,23
- 3; 49,0; 49,0; 44,2±1,38; 121,4 ±1,83; 3,2±0,36
- 4; 24,5; 73,5; 49,5±0,91; 94,4±1,74; 3,8±0,25
- 5; 0; 98,0; 60,4±2,01; 60,2±1,44; 4,9±0,72
- 6; 0; 98,0; 40,3±0,88; 174,0±1,83; 2,8±0,30
* Примечание: Данные опытов 1…5 приведены при выращивании бактерий в минеральных средах, содержащих 2 % дейтеро-метанол и указанные концентрации D2О. Данные опыта 6 приведены для адаптированных к максимальному содержанию дейтерия в среде бактерий при выращивании в среде с максимальными концентрациями D2О. В качестве контроля использовали опыт 1, где применяли обычную воду и метанол.
Показано, что эффекты, наблюдаемые при росте и адаптации клеток различных организмов к дейтерию, носят комплексный многофакторный характер и связаны с изменениями морфологических, цитологических и физиологических параметров — величины лаг-периода, времени клеточной генерации, выходов биомассы, соотношения синтезируемых аминокислот, белков, нуклеозидов, углеводов и жирных кислот при росте в D2O, а также с уровнем эволюционной организации исследуемого объекта. Общей особенностью клеток исследуемых организмов в условиях адаптации к дейтерию является пропорциональное увеличение продолжительности лаг-периода и времени клеточной генерации при уменьшении выходов микробной биомассы. Полученные свидетельствуют о том, что клетка реализует особые адаптивные механизмы, способствующие функциональной реорганизации работы жизненно-важных систем в D2О. Наиболее чувствительными к замене Н+ на D+ признаны аппарат биосинтеза макромолекул и дыхательная цепь, т. е. те клеточные системы, использующие высокие скорости образования и разрыва водородных связей. Данный факт позволяет рассматривать биологическое воздействие дейтерия на клетку как комплексное воздействие. Также возможно, что в процессе адаптации к дейтерию изменяется соотношения основных клеточных метаболитов. Кроме того, присутствие дейтерия вызывает физиологические, морфологические и цитологические изменения в клетках изученных микроорганизмов, что в конечном итоге приводит к формированию в D2O крупных атипичных клеток, состоящих из плотно упакованных мембран, наподобие мезосом, имеющих в 2…3 раза более толстую клеточную стенку; чем протонированные клетки с неравномерным распределением ДНК [6, 7]. Мезосомы — внутрицитоплазматические бактериальные мембранные структуры везикулярной и трубчатой формы, образующиеся путем инвазии плазматической мембраны внутрь цитоплазмы. Предполагается, что мезосомы участвуют в образовании клеточных перегородок, репликации и сегрегации ДНК, нуклеотидов и др. процессах. Большинство мезосом отсутствует в нормальных клетках и образуются при действии некоторых внешних химических факторов, низких и высоких температур, колебаниях показателя рН и др. воздействиях. Кроме того, для дейтерированных клеток сине-зеленой микроводоросли C. vulgaris было также характерно резкое изменение формы клеток и направления их деления. Наблюдаемые морфологические изменения, связанные с торможением роста дейтерированных клеток, обусловлены перестройкой в процессе адаптации к D2O. Факт, что дейтерированные клетки имеют более крупные размеры (кажущийся размер в 2…4 раза превосходит размер протонированных клеток), является общебиологическим и наблюдается при выращивании в D2O целого ряда других адаптированных нами прокариотических и эукариотических клеток.
Полученные данные, в целом, подтверждают устойчивое представление о том, что адаптация к D2О является фенотипическим явлением, поскольку адаптированные к D2O клетки возвращаются после их переноса на обычную водную среду к нормальному росту после некоторого лаг-периода. В то же время эффект обратимости роста на H2O/D2O-средах не исключает возможности того, что определенный генотип детерминирует проявление одного и того же фенотипического признака в средах различного изотопного состава.
Как показали наши исследования, чувствительность различных биологических объектов к D2O различная. Относящиеся к прокариотам сине-зеленые водоросли способны расти на 70 % D2O, метилотрофные бактерии — 75 % D2O, хемогетеротрофные бактерии — 82 % D2O, а галофилы — 95 % D2O (рис. 1).
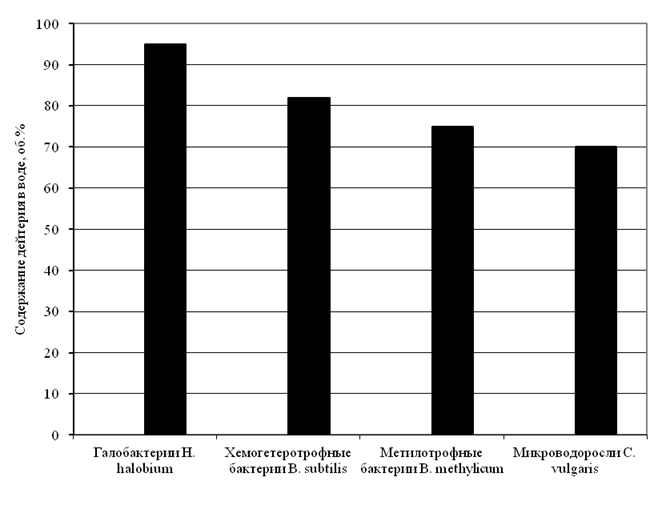
Рис. 1. Выживаемость клеток изученных микроорганизмов в воде с различным содержанием дейтерия по данным экспериментальных исследований авторов
В процессе клеточной адаптации к D2O наиболее важными для структуры макромолекулы являются динамические короткоживущие водородные (дейтериевые) связи. Водородная связь имеет важное значение в химии межмолекулярных взаимодействий и обусловлена слабыми электростатическими силами и донорно-акцепторными взаимодействиями с переносом заряда. Она возникает при взаимодействии электронодефицитного атома водорода (дейтерия) с не поделенной электронной парой гетероатомов О, С, N, S и играет существенную роль в поддержании пространственной структуры макромолекул и в межмолекулярных взаимодействиях. Структура водородной связи может быть представлена следующим образом: О···Нd+–Оd-. Замещение атомов водорода дейтерием изменяет конформацию и стабильность водородных (дейтериевых) связей в макромолекулах протеинов и ДНК, способствующих поддержанию их структуры и стабильности. Связи, сформированные атомами дейтерия различаются по прочности и энергии от аналогичных водородных связей. Различия в нуклеарной массе атома H и D могут служить причиной различий в синтезах нуклеиновых кислот, которые могут приводить к структурным различиям и к функциональным изменениям в клетке. Ферментативные функции и структура синтезируемых белков также изменяются при росте клеток в D2O, что может отразиться на процессах метаболизма и деления клетки. Другое важное свойство определяется пространственной структурой D2O, имеющей тенденцию сближать гидрофобные группы макромолекул, чтобы минимизировать их эффект на водородную (дейтериевую) связь в присутствии молекул D2O. Поэтому структура макромолекул белков и нуклеиновых кислот в D2О несколько стабилизируется [8]. При помещении клеток биологических объектов в D2O, из них не только удаляется протонированная вода за счет реакции изотопного обмена Н2О–D2О, но и происходит быстрый изотопный (H–D) обмен в гидроксильных (-ОН), сульфгидрильных (-SH) и аминогруппах (-NH2) всех органических соединений, включая белки, нуклеиновые кислоты, углеводы и липиды. Известно, что в этих условиях только ковалентная С–Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С–D могут синтезироваться de novo [9].
В зависимости от положения атома дейтерия в молекуле, различают первичные и вторичные изотопные эффекты, опосредованные межмолекулярными взаимодействиями. Другое важное свойство определяется пространственной структурой D2O, имеющей тенденцию сближать гидрофобные группы макромолекул, чтобы минимизировать их эффект на водородную (дейтериевую) связь в D2O. Поэтому структура макромолекул белков и нуклеиновых кислот в присутствии D2О стабилизируется.
Эффект торможения роста клеток в присутствии D2О может быть компенсирован повышением температуры окружающей среды. Аналогия с повышением температуры позволяет рассматривать адаптацию к дейтерию как адаптацию к неспецифическому фактору, действующему одновременно на функциональное состояние большого числа систем: метаболизм, пути ассимиляции углеродных субстратов, структуру и функции макромолекул и др.
Биологические эксперименты с дейтерием дают возможность прогнозировать и моделировать условия, при которых зародилась жизнь. Маловероятно, что жизнь могла возникнуть в хаотической неинформационной воде. Живые организмы и вода являются сложными, самоорганизующимися системами с характерной структурой. Самыми благоприятными для зарождения жизни признаны теплые и горячие минеральные воды, взаимодействующие с СаСО3, и поэтому имеющие щелочной показатель pH, а затем морские воды [10, 11]. Циркулируя в полостях, микротрещинах и каналах, воды карстовых источников обогащаются Са(HCO3)2, активно взаимодействующим с органическим веществом и могут содержать информацию о жизни в более поздние геологические периоды. При этом самоорганизация первичных органических соединений в водной среде поддерживалась термальной энергией магмы, вулканической деятельностью и солнечной активностью.
Нами были проведены эксперименты по исследованию минеральной, морской и горной воды из Болгарии ИК-спектроскопией и методом дифференциально неравновесного энергетического спектрального анализа (ДНЭС) относительно контроля — деионизированной воды (рис. 2, кривые 1–5). В ходе эксперименты были исследованы образцы воды из карстовых источников. Также методом ДНЭС были исследованы спектры сока кактуса (рис. 2, кривая 1). Кактус был выбран в качестве модельной системы, потому что растение содержит ~90 масс.% воды. Полученные данные продемонстрировали, что наиболее близким к спектру сока кактуса являлся спектр минеральной воды, контактирующей с СаСО3 (рис. 2, кривая 2). Аналогичный спектр имеют карстовые воды (рис. 2, кривая 4). При этом наиболее близкий к спектру сока кактуса (рис. 2, кривая 1) имел спектр карстовых вод, взаимодействующих с минеральной водой. Так, спектры растительного сока, минеральная вода и вода карстовых источников, взаимодействующих с CaCO3, имели значения пиков локальных максимумов в спектрах при –0,1112; –0,1187; –0,1262; –0,1287 и –0,1387 эВ. Подобные пики в спектре между растительным соком, горной и морской водой детектировались при –0,1362 эВ. Спектр контрольного образца деионизированной воды (рис. 2, кривая 5) существенно отличался от спектра морской минеральной и горной воды.

Рис. 2. Дифференциальные неравновесные энергетические спектры (ДНЭС) образцов воды различного происхождения: 1 — сок кактуса; 2 — минеральная вода местечка Рупит (Болгария); 3 – морская вода (курорт Варна, Болгария); 4 – горная вода (Тетевен, Болгария); 5 — деионизированная вода (контроль). По оси абсцисс показана энергия водородных H...O связей между молекулами H2O — E (эВ), по оси ординат — функция распределения молекул Н2О по энергиям –D f (эВ-1).
Как следует из вышеприведенных данных, более всего к ДНЭС-спектру сока кактуса приближался ДНЭС-спектр минеральной воды из местечка Рупите) Болгария), ИК-спектр которой показан на рисунке 3. Спектры растительного сока и минеральной воды с концентрацией ионов HCO3- (1320…1488 мг/л), Ca2+ (29…36 мг/л) и показателем pH = 6,85…7,19, имеют локальные максимумы при длинах волн λ = 8,95; 9,67; 9,81; 10,47 и 11,12 мкм. Локальные максимумы в ИК-спектрах между растительным соком и морской водой детектируются при λ = 9,10 мкм. Локальные максимумы, полученные методом ИК-спектроскопии при λ = 9,81 мкм (1019 см-1) и λ = 8,95 мкм (1117 cм-1) расположены на спектральной кривой локального максимума при λ = 9,7 мкм (1031 cм-1). С помощью метода ДНЭС были получены следующие данные — 8,95; 9,10; 9,64; 9,83; 10,45; 11,15 мкм (длина волны, λ) или 897; 957; 1017; 1037; 1099; 1117 см-1 (волновое число, k) (таблица 2).
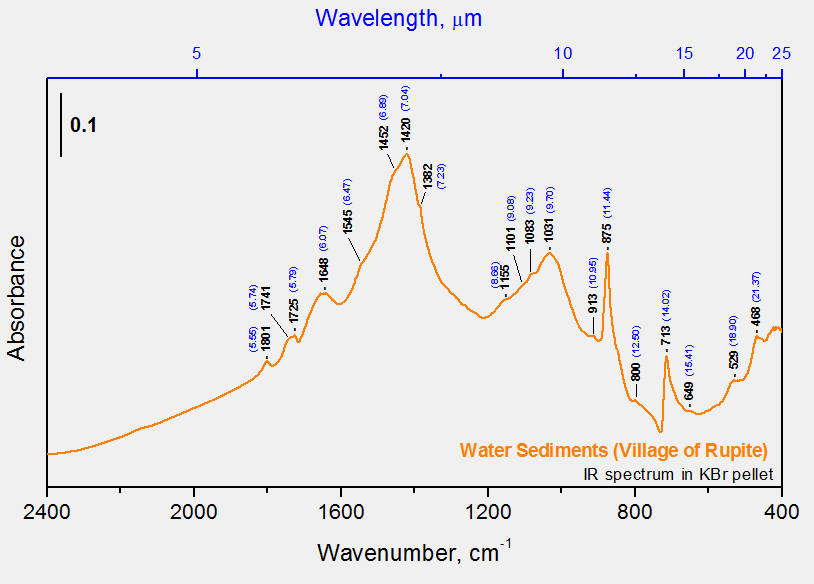
Рис. 3. ИК-спектр минеральной воды из местечка Рупите (Болгария). На нижней оси абсцисс показано волновое число (см-1); на верхней оси абсцисс — длина волны (мкм); на оси ординат — поглощение (усл. ед.)
Таблица 2
Характеристики спектров (ДНЭС-метод) воды различного происхождения*
- Энергия водородных связей, -E (эВ); Длина волны l, мкм; Волновое число k, cм-1
- Сок кактуса; Минеральная вода Рупите; Морская вода
- 0,1112; 0,1112; –; 11,15; 897
- 0,1187; 0,1187; –; 10,45; 957
- 0,1262; 0,1262; –; 9,83; 1017
- 0,1287; 0,1287; –; 9,64; 1037
- 0,1362; –; 0,1362; 9,10; 1099
- 0,1387; 0,1387; –; 8,95; 1117
* Примечание: Функция распределения молекул Н2О по энергиям (∆f) измеряется в электронвольтах (эВ-1). Показано при каких значениях энергии водородной связи (-E (эВ)) наблюдаются самые большие локальные максимумы этой функции.
Такой характер распределения локальных максимумов в ДНЭС- и ИК-спектрах воды свидетельствует о том, что горячая минеральная вода лучше удовлетворяет условиям возникновения жизни, чем другие анализируемые образцы воды из других водных источников. Так, в ИК-спектре горячей минеральной воды локальные максимумы более выражены, чем локальные максимумы в ИК-спектрах этой же воды при более низкой температуре. Разница в значениях локальных максимумов при увеличении температуры от +20 0C до +95 0C на каждые 5 0C составляет согласно t-критерию Стьюдента — p < 0,05.
Методом ДНЭС был измерен другой важный параметр — величина средней энергии (∆EH...O) водородных Н…О-связей между молекулами H2O в процессе формирования кластерных ассоциатов формулы (H2O)n, составляющие –0,1067±0,0011 эВ. При изменении температуры воды средняя энергия водородных H...O связей в ассоциатах молекул H2O изменяется. Эти данные свидетельствуют о том, что возникновение жизни зависит как от структуры и свойств воды, так и от внешних факторов — температуры и показателя рН. Данным условиям наиболее лучше удовлетворяет взаимодействующая с CaCO3 теплая и горячая минеральная вода. Затем по качеству следует морская вода. В теплых и горячих минеральных водах пики в неравновесном энергетическом спектре более выражены по сравнению с пиками, полученными в той же воде с более низкой температурой. Это показывает на большую энергию для сохранения самоорганизованных структур во времени и интенсификацию биохимических реакций в условиях повышенных температур. Спектральный диапазон исследованных образцов воды находился в среднем ИК-диапазоне от 8 до 14 мкм. Предполагается, что в этом диапазоне существует окно прозрачности земной атмосферы для электромагнитной радиации. В этом интервале энергия излучается от Солнца к Земле, и от Земли в окружающее пространство.
Полученные данные свидетельствуют о наиболее большей вероятности происхождения жизни в теплой и горячей воде с показателем pH 9…10. Авторам кажется маловероятным, что жизнь могла возникнуть в хаотичной
водной среде. Живые организмы — высокоорганизованные структуры. При рассмотрении природных процессов самоорганизации существует интересный феномен, найденный в карстовых источниках местечка Златна Панега, Тетевен (Болгария). Обитающие там сине-зеленые водоросли окружены пузырьками диаметром 3…5 мм, время существования которых составляет от нескольких часов до дней. Вода, ДНЭС-спектр которой аналогичен ДНЭС-спектру растительного сока, имеет тенденцию сохранять самоорганизацирующие структуры. При добавлении к раствору пектинов катионов Ca2+, раствор принимает желатинизорованную структуру, поскольку катионы Ca2+ обладают способностью связывания с молекулами пектина с формированием металло-органических комплексов. Очевидно, эти комплексы играют существенную роль в объединении различных компонентов клеточной мембраны и влияют на ее компактность и прочность.
В этой связи важны следующие реакции, протекающие в водных растворах :
CO2 + 4H2S + O2 = CH2O + 4S + 3H2O (1)
СаСО3+ HOH + СО2 = Ca(HCО3)2 (2)
CO2 + ОН- = HCО3- (3)
2HCO3- + Ca2+ = CaCO3 + CO2 + H2O (4)
Уравнение (1) показывает, что некоторые хемосинтетические бактерии в анаэробных условиях в присутствии СО2 используют энергию, полученную в результате окисления H2S до S. Уравнение (2) связано с одним из самых распространëнных процессов в природе — формированием Ca(HCО3)2 из CaCO3 в присутствии Н2О и СО2. При наличии в водной среде гидроксил-ионов СО2 превращается в HCО3- (уравнение (3)). Уравнение (4) демонстрирует процессы, сопровождающие формирование строматолитов — древнейших известковых (доломитовых) ископаемых докембрийского периода, которые строили свой скелет из извести.
Вероятнее всего первые органические формы жизни возникли в горячей минеральной воде с повышенным содержанием дейтерия, поскольку как было показано нами раннее, в условиях первичной бескислородной атмосферы, лишенной озонового слоя, под воздействием геотермальной энергии, коротковолнового излучения Солнца и мощных искровых разрядов, в первичной гидросфере могли образовываться и накапливаться некоторые количества HDO. Эти данные также могут служить подтверждением возможного пути перехода от синтеза малых органических молекул за счет энергии УФ-излучения Солнца и температуры к более сложным органическим молекулам протеинов и нуклеиновых кислот. Молекулы протеинов построены из одной или нескольких полипептидных цепей, состоящие из большого числа различных α-аминокислот, связанных друг с другом посредством пептидной (–CO–NH–) связи. Их последующая конденсация в полипептидные цепи может произойти в определенных условиях, после их образования. Важным фактором в реакции конденсации двух молекул аминокислот является выделение молекулы Н2О. Поскольку реакция поликонденсации аминокислот сопровождается дегидратацией, при удалении Н2О из системы скорость химической реакции увеличивается. Этот факт свидетельствует о том, что раннее развитие жизни происходило вблизи действующих вулканов, поскольку в ранние периоды геологической истории вулканическая деятельность происходила более активно, чем в последующие геологические времена. Дегидратация сопровождает не только полимеризацию аминокислот, но и объединение других блоков в более крупные органические молекулы, а также полимеризацию нуклеотидов в нуклеиновой кислоты. Такое объединение всегда связано с реакцией конденсации, при которой от одного блока отщепляется протон Н+, а от другого — гидроксильная группа ОН- с образованием молекулы Н2О.
Впервые возможность существования реакций конденсации-дегидратации в условиях первичной гидросферы, катализируемые синильной кислотой (HCN) и ее произодными — цианамидом (CH2N2) и дицианамидом (HN(CN)2), доказал в 1965 г. М. Кальвин [12]. HCN, CH2N2 и HN(CN)2 обладают дегидратирующей способностью и способностью катализировать процесс связывания молекулы Н2О первичной гидросферы [13]. На присутствие HCN в первичной гидросфере указывают и ранние эксперименты C. Миллера. В присутствии HCN и цианамидов конденсация отдельных блоков, сопровождаемая дегидратацией, происходит при нормальных температурах в сильно разбавленных водных растворах (рис. 4). Ракции поликонденсации аминокислот в присутствии HCN и ее производных зависят от кислотности водных растворов, в которых они протекают [14]. В кислых водных средах (рН = 4…6) эти реакции не происходят, тогда как щелочные условия (рН = 8…9) способствуют их протеканию. В настоящее время не существует однозначного мнения, обладала ли первичная гидросфера щелочным показателем pH, но вероятно, что именно таким значением рН обладала поверхностная озерная и минеральная вода, соприкасавшаяся с базальтом, и эти реакции могли происходить при контакте воды с базальтовыми породами.
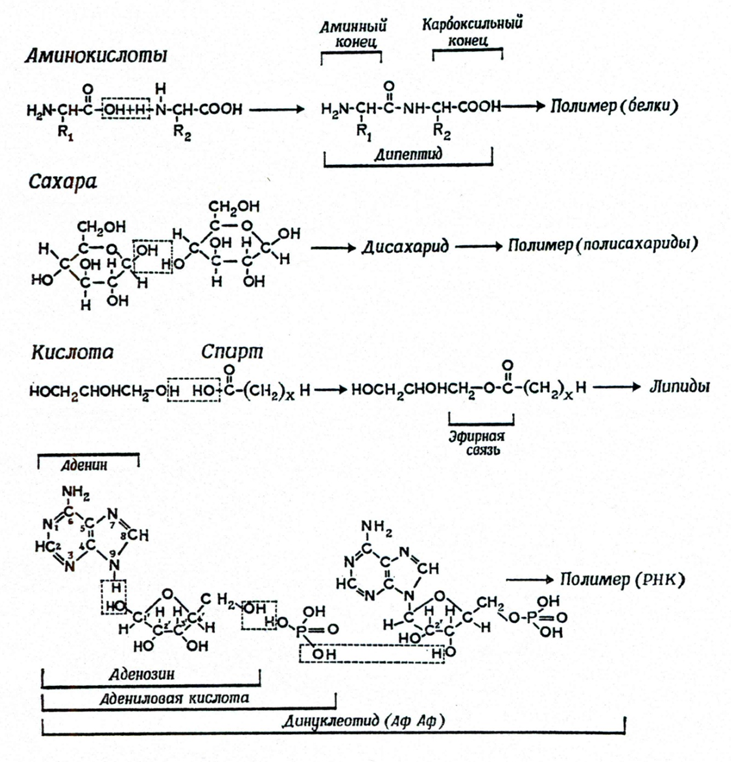
Рис. 4. Реакции конденсации и дегидратации, катализируемые HCN и ее производными, приводящие к образованию из отдельных молекул более крупных органических молекул. Верхние три уравнения: конденсация и последующая полимеризация аминокислот в протеины, углеводов в полисахариды и кислот и спиртов в липиды. Нижнее уравнение - конденсация аденина с рибозой и Н3РО3, приводящая к образованию динуклеотида [14]
Свидетельством, что в синтезе органических молекул могли использоваться геотермальные источники энергии является тот факт, что в водных растворах формальдегида, гидроксиламина и гидразина, содержащих НCN, после нагрева реакционной смеси до температуры 95 0С в конце эксперимента обнаруживались аминокислоты [15]. В других экспериментах продукты реакции этих соединений полимеризовались в пептидные цепи, что является важным этапом на пути к неорганическому синтезу белка [16]. Так, в реакционной смеси с раствором HCN в водном NH3 и формамидина из предшественников азотистых оснований — 4-аминоимидазол-5-карбоксамидина, 4-аминоимидазол-5-карбоксамида и мочевины также образуются более сложные соединения, входящие в состав нуклеиновых кислот — пурины (рис. 5а,б).

Рис. 5. Предполагаемые механизмы образования пуринов
a) — образование аденина, гуанина и ксантина из предшественников азотистых оснований — 4-аминоимидазол-5-карбоксамидина, 4-аминоимидазол-5-карбоксамида и мочевины в водной среде с NH3, HCN и формамидином;В модельных условиях первичной гидросферы безводную смесь аминокислот подвергали воздействию температур от 60 0С до 170 0С с образованием коротких белковоподобных соединений, названных термическими протеиноидами. Наилучшие результаты по поликонденсации получались со смесями аминокислот, содержащими аспарагиновую и глутаминовую кислоты, относящиеся к числу незаменимых аминокислот, встречающихся во всех живых организмах. 
Рис. 5. Предполагаемые механизмы образования пуринов
б) — образование аденина из водной смеси NH3–HCN– CH2N2 при температуре +95 0С (суммарная реакция: 5HCN = аденин).Синтезируемые термические протеиноиды состоят из крупных молекул с молекулярной массой до 300000, состоящих из тех же аминокислот, что и природные белки. По количественному составу они содержат 18 из 22 аминокислот, обычно встречающихся у современных организмов, что сооответствует общему определению белка [17]. С природным белком протеиноиды сходны и по ряду других важных свойств: по связыванию полинуклеотидов, по пригодности в пищу бактериям и крысам, по способности вызывать биохимические реакции, сходные с теми, которые катализируются ферментами в живых организмах. Cинтетические протеиноиды способны каталитически разщеплять глюкозу [18] и оказывать действие аналогичное действию меланоцитстимулирующего гормона [19]. Другим важным свойством термических протеиноиноидов является их гетерогенность: т.е. последовательность аминокислот в их пептидных цепях не случайна, а, напротив, закономерна. При последующей промывке горячей смеси протеиноидов водой или водными растворами солей, в водной среде образуются элементарные мембраноподобные микросферы с диаметром 5…10 мкм. [20]. По морфологическим особенностям микросферы напоминают мембрану клетки, которая в некоторых условиях может быть двойной (рис. 6).
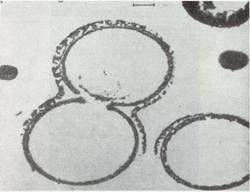
Рис. 6. Электронные микрофотографии срезов протеноидных коацерватов в сканирующем электронном микроскопе (увеличение ´ 5000 раз). Видны двойные мембраны [20].Синтез протеноидных микросфер из смеси искусственных термических протеинов важен, поскольку он дает материал о следующем этапе эволюции жизни. Это этап от разрозненных органических молекул к организованным протеноидным молекулам — коорцерватам, обладающих организованной структурой и отделенными от окружающего мира примитивной мембраной — аналогом мембраны клетки, что было впервые продемонстрировано в 1962 г. выдающимся Российским ученым академиком А.И. Опариным [21].
С учетом вышеназванных факторов происхождение жизни выглядит следующим образом. Начальным этапом эволюции, по-видимому, было образование в первичной гидросфере и насышенной водяными парами и смесями газов — CO, Н2, N2, NH3 и CH4 атмосфере при высоких температурах аминокислот и азотистых соединений — аналогов нуклеиновых кислот. Как было показано нами раннее, такой синтез возможен в условиях восстановительной атмосферы при наличии в водной среде H3PO3 и воздействии электрических разрядов, ультрафиолетового излучения и высоких температур [22]. Следующим этапом является поликонденсация аминокислот в термические протеиноиды при температурах 65…170 0С в присутствии H3PO4 и фосфатов при наличии в водной смеси достаточных количеств аспарагиновой и глутаминовой кислот. Затем в смеси термических протеиноидов при воздействии на них водой или кислыми водными растворами (дождем) могли образоваться протеиноидные микросферы — предшественники проклеток, обладающие каталитической активностью. Способность термических протеиноидов к выполнению некоторых биохимических функций, сходных с функциями ферментов живых организмов, выражается в том, что они способны в присутствии катионов Zn2+ расщеплять АТФ, т. е. обладают слабой ферментативной активностью [23] Впоследствие у микросфер могла появиться способность к синтезу РНК, которые могли случайным образом кодировать короткие белки. Подтверждением того, что жизнь образовалась в горячей воде служат недавние исследования Т. Сугавары, который воздействуя на водную смесь органических молекул, ДНК и протеинов при температуре +95 0С получил протоклетки, обладающие элементарной мембраной [24].
Большой фактический материал дает и изучение строматолитов — древнейших известковых (доломитовых) ископаемых докембрийского периода, которые строили свой скелет из известняка и диоксида кремния SiO2. Строматолиты формировались на дне неглубоких водоемов еще в архее в самую древнюю геологическую эпоху Земли — 3,0…3,5 млрд лет назад. Изучать эти образования очень важно и интересно, так как строматолиты хранят в себе сведения о зарождающейся жизни на Земле и органическом составе первых живых организмов — многочисленных колоний цианобактерий, сине-зелёных водорослей и нефтеперерерабатывающих бактерий, возникающих в толщах известняков и доломитов в жерлах погасших вулканов и термических источников.
В 2010 г. Д. Вард описал ископаемые строматолиты Йеллоустонского национального парка США [25]. Были изучены микроорганизмы, формирующие строматолиты в горячей воде аналогично древним организмам в зонах вулканической активности, нагреваемых магмой. Этот факт является подтверждением нашей гипотезы, основанной на биофизических исследованиях происхождения первых органических форм в теплых и горячих минеральных водах и гейзерах с повышенным содержанием дейтерия. В декабре 2012 г. сообщение на данную тему было опубликовано авторами на конгрессе Euromedica в Ганновере (Германии) [26]. В сентябре 2010 г. американские ученые Р. Стокбридж, С. Льюис, Дж. Юань и Р. Вольфенден опубликовали статью Воникла ли жизнь в горячей воде?, в которой была продемонстрирована вероятность протекания более быстрых биохимических реакций в горячей воде [27].
В 2011 г. группа ученых из университета в Лионе (Франция), под руководством Мари-Лор Понс, исследовали некоторые из самых старых осадочных пород планеты и обнаружили в их составе включения органогенных групп минералов магниево-железистых гидросиликатов, аналогичных серпентину (змеевик) с общей формулой X2-3Si2O5(OH)4, где X = Mg2+, Fe2+, Fe3+, Ni2+, Al3+, Zn2+, Mn2+ [28]. Еще раньше считалось, что первые органические формы появились вблизи гейзеров с высокой концентрацией Mg2+, Fe2+, Fe3+, Zn2+, Mn2+, Ca2+. Исследования показали, что вода в гейзерах Гренландии богата карбонатами, имеет щелочной показатель рН 8…9, а температура находится в пределах 100…170 0C. Следует подчеркнуть, что геотермические и вулканические процессы могли происходить и в морских глубинах. Эти новые результаты являются потверждением возможного зарождения жизни в горячей минеральной воде. Существенным фактом является и то, что процесс возникновения первых форм жизни был связан с карбонатами.
Выводы
Полученные данные свидетельствуют о том, что первичная вода на начальных этапах эволюции имела повышенную температуру и щелочную реакцию за счет взаимодействия с CaCO3, и могла содержать больше дейтерия в форме HDO. Если это так, что это является существенным фактом термоустойчивости и стабильности дейтерированных макромолекул в поддержании жизни в условиях повышенных температур, поскольку связи образованные с участием дейтерия прочнее связей, образованных с участием водорода. Поскольку характер земной атмосферы впоследствии изменился с восстановительного на окислительный, условия на Земле изменились, что могло способствовать очистке гидросферы от дейтерия. Определенную роль в этом процессе могли играть карстовые породы. Горячая минеральная вода с температурой 65 0С и показателем рН 9…10, взаимодействующая с CaCO3, более всего удовлетворяет условиям первичной гидросферы и образованию первых органических форм. Далее по качеству следует морская вода.
Библиографический список
1. 1. Linsky J.L. D/H and nearby interstellar cloud structures / in: R. Steiger, G. Gloeckler, G. Mason (eds.). Space Sciences Series of ISSI. New York: Springer Science. 2007, Vol. 27, 375 p.
2. Lis G., Wassenaar L.I., Hendry M.J. High-Precision Laser Spectroscopy D/H and 18O/16O Measurements of Microliter Natural Water Samples // Anal. Chem. 2008. Vol. 80(1). P. 287–293.
3. Ignatov I., Mosin O.V. Modeling of possible processes for origin of life and living matter in hot mineral and seawater with deuterium // Journal of Environment and Earth Science. 2013. V. 3. № 14. P. 103–118.
4. Лобышев В.Н, Калиниченко Л.П. Изотопные эффекты D2O в биологических системах. М.: Наука, 1978. 215 с.
5. Мосин О.В., Игнатов И. Изучение изотопных эфектов тяжелой воды (D2O) в биологических системах на примере клеток прокариот и эукариот // Биомедицина. 2012. Т. 1. № 1–3. С. 31–50.
6. Мосин О.В., Игнатов И. Изотопные эффекты дейтерия в клетках бактерий и микроводорослей // Вода: химия и экология. 2012. № 3. C. 83–94.
7. Ignatov I., Mosin O.V. Structural mathematical models describing water clusters // Mathematical theory and modeling. 2013. V. 3. № 11. P. 72–87.
8. Vertes A. Physiological effects of heavy water. Elements and isotopes: formation, transformation, distribution. Dordrecht: Kluwer Acad. Publ. 2004, 112 p.
9. Ignatov I., Mosin O.V. Modeling of possible processes for origin of life and living matter in hot mineral and seawater with deuterium // Journal of environment and earth science. 2013. V. 3. № 14. P. 103–118.
10. Ignatov I. Which water is optimal for the origin (generation) of life? Hanover: Euromedica. 2010. 95 c.
11. Ignatov I. Origin of life and living matter in hot mineral water. Conference on the Physics, Chemistry and Biology of water. New York: Vermont Photonics. USA. 2012. 115 p.
12. Кальвин М. Химическая эволюция. М.: Мир, 1971. 150 c.
13. Mathews C.N., Moser R. Peptide synthesis from hydrogen-cyanide and water // Nature. 1968. Vol. 215. P. 1230–1234.
14. Abelson P. Chemical events on the primitive earth. // Proc. Natl. Acad. Sci. U. S.A. 1966. Vol. 55. P. 1365–1372.
15. Harada I., Fox S.W. Thermal synthesis of natural ammo-acids from a postulated primitive terrestrial atmosphere // Nature. 1964. Vol. 201. P. 335–336.
16. Оrо J. Prebiological organic systems / in: S.W. Fox (ed.). The Origin of Prebiological Systems. New York: Academic Press, 1965. 162 p.
Fox S. W., Harada K., Woods K.R., Windsor Ch.R. Amino Acid compositions of proteinoids // Archives of Biochemistry and Biophysics. 1963. Vol. 102 (3). P. 439–445.
18. Fox S.W., Krampitz G. Catalytic decomposition of glucose in aqueous solution by thermal proteinoids // Nature. 1964. Vol. 203. P. 1362–1364.
19. Fox C.W., Wang C.T. Melanocytestimulating hormone: Activity in thermal polymers of alpha-ammo acids // Science. 1968. Vol. 160. P. 547–548.
20. Nakashima T. Metabolism of proteinoid microspheres // Origins of Life and Evolution of Biospheres. 1987. Vol. 20(3–4). P. 269–277.
21. Опарин А.И. Пути начально формирования обмена веществ и искусственное моделирование этого формирования в коацерватных каплях / в кн: С. Фокс (ред.). Происхождение предбиологических систем. М.: Мир, 1966. 137 с.
22. Игнатов И., Мосин О.В. Цветной коронный спектральный анализ Кирлиана в моделировании неравновесных условий с газовым электрическим разрядом, имитирующих первичную атмосферу // Наноинженерия. 2013. № 12(30). С. 3-12
23. Мосин О.В., Игнатов И. Структура воды // Химия. 2011. № 11. C. 24–27.
24. Sugawara T. Self-reproduction of supramolecular giant vesicles combined with the amplification of encapsulated DNA // Nature Chemistry. 2011. Vol. 1127. P. 775–780.
25. Ward D. First Fossil-Makers in Hot Water // Astrobiology magazine. 2010. №1.
www.astrobio.net/exclusive/3418/first-fossil-makers-in-hot-water.
26. Ignatov I., Mosin O.V. Isotopic composition of water and its temperature in modeling of primordial hydrosphere experiments. Hanover: Euro-Eco. 2012. 162 p.
27. Stockbridge R.B., Lewis C.A., Yuan Jr.Y., Wolfenden R. Can life be originated in hot water? // Proc. Natl. Acad. Sci. U.S.A. 2010. Vol. Vol. 107. P. 22102–22105.
28.Pons M.L. Early Archean serpentine mud volcanoes at Isua, Greenland, as a niche for early life // Proc. Natl. Acad. Sci. U.S.A. 2011. Vol. 108. P. 17639–17643.