Извлечение сырьевых ресурсов из морской воды
Океан является огромной кладовой химических веществ. В каждой кубической миле морской воды содержится 1,5 -1011 кг растворенных твердых веществ. Океан столь огромен, что если концентрация какого-либо вещества в морской воде составляет всего 1 миллиардную долю по весу, то его содержание в мировом океане исчисляется в 5-109 кг. Тем не менее океан еще мало используется как источник сырьевых материалов, поскольку стоимость извлечения необходимых веществ из воды слишком высока. Лишь три вещества получают из морской воды в промышленно широких масштабах: хлорид натрия, бром и магний.
ХЛОРИД НАТРИЯ
Поскольку хлорид натрия-самое распространенное вещество из числа растворенных в морской воде, нет ничего удивительного в том, что значительное количество (приблизительно 4.1010кг ежегодно) чистого хлорида натрия получают из морской воды. С этой целью морскую воду фильтруют и затем дают ей испаряться до тех пор, пока концентрация содержащегося в ней NaCl не превысит его растворимости. Твердый NaCl, который выкристаллизовывается из морской воды, оказывается довольно чистым, но его можно перекристаллизовывать из пресной воды до еще более высокой степени чистоты в зависимости от дальнейшего использования.
БРОМ
Ежегодно во всем мире получают более 2,3 • 108 кг брома, главным образом из морской воды. Концентрация бромид-иона в морской воде составляет всего 8,3.10 –4 М. На первой стадии извлечения брома из морской воды к ней добавляют серную кислоту, что снижает рН до 3,5. Затем через подкисленную воду продувают газообразный хлор в некотором избытке по сравнению с содержащимся в ней бромом. Между растворенным в воде газообразным хлором и бромид-ионом протекает окислительно-восстановительная реакция:
С12(водн.) + 2Вr(водн.) = Вr2(водн.) + 2С1(водн.)
Для выделения брома из морской воды ее пропускают через специальную башню, выложенную брусками дерева; в обратном направлении через башню продувают воздух. Для выделения брома из потока прошедшего через башню воздуха его обрабатывают сернистым ангидридом SO2 и паром. В результате образуются бромистоводородная и серная кислоты:
SO2(r.) + Вr2(г.) + 2Н2О(ж.) = 2НВr(водн.) + Н2SО4(водн.)
Чтобы извлечь бром из этого раствора, его снова обрабатывают надлежащим количеством хлора и затем удаляют бром, продувая воздухом. После этого смесь газообразного брома с воздухом пропускают над холодной поверхностью. Температура кипения жидкого брома составляет 59°С, что позволяет отделять его от воды перегонкой. Разбавленная серная кислота, остающаяся после удаления брома, используется для подкисления свежей порции впускаемой морской воды.
МАГНИЙ
Магний-второй по содержанию металлический элемент в морской воде. Самый большой завод для получения магния из морской воды в США принадлежит компании «Доу Кемикл» и находится в г. Фрипорте (штатт Техас). На этом заводе Mg2+ осаждают из морской воды в больших отстойниках (рис.1) в виде Mg(OH)2 (ПР = = 1,8.10 -11) путем добавления к морской воде негашеной извести СаО.
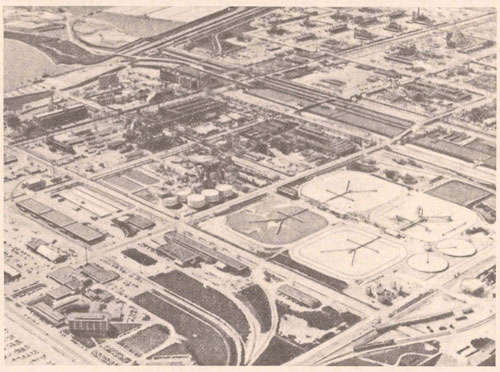
Рис. 1. Вид сверху на отстойники (в центре) для осаждения гидроокиси магния из морской воды на заводах компании «Доу Кемикл» (США). Рисунок из книги Т. Брауна “Химия в центре наук”, М, Мир, 1983
Оксид кальция для данного процесса в свою очередь получают из раковин моллюсков. Раковины моллюсков состоят из карбоната кальция. Их промывают, затем прокаливают в специальной обжиговой печи и таким образом получают негашеную известь:
СаСО3(тв.) = СаО(тв.) + СО2(г.)
Гидроксид магния получают по реакции:
Мg2+(водн.) + СаО(тв.) + Н2О(ж.) = Мg(ОН)2(тв.) + Са2+(водн.)
Осаждающийся гидроксид магния содержит примеси ионов Са2+, Na+ и HCO3. Твердый осадок отфильтровывают и затем обрабатывают смесью растворов НС1 и H2SO4. В кислом растворе происходит растворение Mg(OH)2
Mg(OH)2(тв.) + 2Н+(водн.) = Мg2+(водн.) + 2Н2О(ж.)
Большая часть примесных ионов натрия кристаллизуется в составе NaCl, а ион кальция осаждается в составе CaSO4. Раствор, содержащий ионы Mg2+, отфильтровывают и затем концентрируют в испарителе. Таким образом, в конце концов получают твердый MgCl2. Его растворяют в смеси расплавленных хлоридов металлов при 700°С в электролизных установках (см. рис. 2). Электрическая энергия, подводимая к электролизерам, расходуется на образование из расплавленного хлорида магния металлического магния и газообразного хлора:
электроэнергия
МgС12(ж.) = Мg(ж.) + С12(г.)
Расплавленный металл отливают в слитки, которые имеют чистоту 99,9%. 
Рис. 2. Установки для электролитического получения Mg из MgCl2 на заводе компании «Доу Кемикл» (США). Круглые вертикальные стержни представляют собой угольные аноды, а стержни прямоугольного сечения - медные проводники, по которым в электролизеры подается ток силой до 100000 ампер. Рисунок из книги Т. Брауна “Химия в центре наук”, М, Мир, 1983
Мосин О.В.
👎👍💋👽👀💀😪😍😎😜😇😍😉😆😄😱хыхы