Разные природные воды. Адаптация к тяжёлой воде
Это продолжение статьи, начало - на предыдущей странице данного раздела.
Разные природные воды содержат различное содержание дейтерия. Соотношение между тяжёлой и обычной водой в природных водах составляет 1:5500. Обычная водопроводная вода содержит около 100 г дейтерия на тонну воды, а морская вода от 130 до 150 г дейтерия на тонну воды. Горная вода содержит гораздо меньшее количество дейтерия, чем другие виды вод, что благоприятно сказывается на метаболизм и функционирование организма. Представители Клуба медицинской биофизики из города Тетевена, Болгария провели следующий научный эксперимент под руководством д-ра Игнатова. Они поливали семена одной культуры обычной водопроводной и горной водой. Результаты показали, что растения, политые горной водой, росли быстрее, чем растения, которых поливали обычной водопроводной водой (рис. 2). Согласно полученным данным, большее содержание дейтерия уменьшало проницаемость мембраны клетки и тем самым, замедляло транспорт питательных веществ внутрь клетки. На рисунке ниже показан результат опыта с кукурузой спустя месяц после поливки (д-р Игнатов, Цветкова, 2010).

Рис. 2. Слева – растение, которое поливали водой из-под крана. С правой стороны – растение, которое поливали горной водой из Тетевена, Болгария (д-р Игнатов, Цветкова, 2010)
Научно достоверные результаты демонстрирует проф. Клима при росте растений, поливаемых разной водой. Проводя научные исследования с водой воде, мы сталкиваемся с ее уникальными свойствами, связанными с зарождением жизни.
Результаты показывают, что дейтерий играет огромную роль в биологических системах. Присутствие дейтерия в биологических системах приводит к изменениям структуры и свойствам жизненно-важных макромолекул таких как дезоксирибонуклеиновые кислоты (ДНК) и протеины. При этом различают первичные и вторичные изотопные эффекты дейтерия в зависимости от того, какое положение занимает атом дейтерия в молекуле. Наиболее важными для структуры макромолекулы связи являются динамические короткоживущие водородные (дейтериевые) связи. Они формируются между соседними атомами дейтерия (водорода) и гетероатомами кислорода, углерода, азота, серы и т.д. и играют главную роль в поддержании пространственной структуры макромолекулярных цепей и как эти структуры взаимодействуют с другими соседними макромолекулярными структурами, а также с тяжелой водной окружающей среды.
При попадании клеток в тяжёлую воду из них не только исчезает протонированная вода за счет реакции обмена Н2О-D2О, но и происходит быстрый H±D обмен в гидроксильных, сульфгидрильных и аминогруппах всех органических соединений, включая белки, нуклеиновые кислоты, липиды, сахара. Только С—Н-связь не подвергается обмену и соединения типа С—D синтезируются «de поvo».
Интересно, что после обмена H±D ферменты не прекращают своей функции (Thоmson et al., 1966; Денько, 1974), но изменения в результате изотопного замещения за счет первичного и вторичного изотопных эффектов (Thomson, 1963; Halevy, 1963), а также действие тяжёлой воды как растворителя (большая структурированность и вязкость по сравнению с обычной водой) приводят к изменению скоростей (замедлению) и специфичности ферментативных реакций в тяжёлой воде.
В 1972 г. Креспи и Катц доказали, что с увеличением процентного содержания дейтерия в воде, рост растений замедляется (рис. 3). Было установлено, что высокие концентрации тяжёлой воды могут приводить к ингибированию многих жизненно-важных мутаций, включая блокировку митоза в стадии профазы, и даже в некоторых случаях вызывать спонтанные мутации. Тяжёлая вода высокой концентрации токсична для организма; химические реакции в её среде проходят несколько медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Так, клетки животных способны выдерживать до 25-30% тяжёлой воды в среде, растений -50%, а клетки простейших микроорганизмов и микроводорослей способны жить на 80% тяжелой воде.

Рис. 3. Поливка томатов 30, 50 и 60%-ной тяжёлой водой ингибирует рост растения (по данным Креспи и Катца, 1972).
В 1996 г. Мосин доказал, что к гибели клеток на тяжёлой воде могут приводить изменение соотношения основных „метаболитов” в процессе адаптации клеток к тяжелой воде. Клетки высших организмов погибают при содержании тяжёлой воды в составе тела свыше 30%, но микроорганизмы, легко приспосабливающиеся к резким изменениям среды обитания, способны жить и размножаться даже в 98%-ной тяжёлой воды (Мосин О.В, 1996). Мосиным в ходе ступенчатой адаптации на агаризованных средах с увеличивающими концентрациями тяжёлой воды были получены адаптированные к тяжёлой воде клетки микроорганизмов, относящиеся к различным таксономическим группам микроорганизмов. Общей особенностью микроорганизмов при росте на тяжёлой воде являлось пропорциональное увеличение продолжительности лаг-фазы и времени клеточной генерации, в то время как выходы микробной биомассы уменьшались (гистограмма 1).
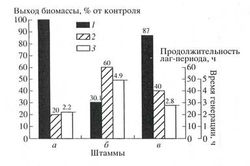
Гистограмма 1. Выход микробной биомассы –1, продолжительность лаг-фазы –2 и время клеточной генерации – 3 для микроорганизма Brevibacterium methylicum при росте на средах с различными концентрациями тяжёлой воды: а – исходный микроорганизм на протонированной среде; б – исходный микроорганизм на 98%-ной тяжёлой воде; в – адаптированный к тяжёлой воде микроорганизм на 98%-ной тяжёлой воде. (О. В. Мосин, 1996)
Характерной особенностью полученных адаптированных к тяжёлой воде объектов являлось то, что весь биологический материал клетки вместо природного водорода содержал дейтерий. Этот факт очень важен для изучения молекулярной организации клетки методами ЯМР-спектроскопии.
Полученные для исследуемых микроорганизмов данные свидетельствуют о том, что способность к адаптации к высоким концентрациям тяжёлой воды связана с эволюционным уровнем организации объекта, т. е. чем ниже уровень развития живого, тем выше способность к адаптации (О.В. Мосин, 1996). Возможно, лёгкость адаптации простейших к тяжёлой воде объясняется тем фактом, что клетка генетически “помнит” из какой воды вышла жизнь. Мосин считает также, что эффекты, наблюдаемые при адаптации к тяжёлой воде связаны с образованием в тяжёлой воде конформаций молекул с иными структурно-динамическими свойствами, чем конформаций, образованных с участием водорода, и поэтому имеющих другую активность и биологические свойства. Так, по теории абсолютных скоростей разрыв СH-связей может происходить быстрее, чем СD-связей, подвижность иона D+ меньше, чем подвижность Н+, константа ионизации тяжёлой воды меньше константы ионизации обычной воды. Всё это отражается на кинетике химической связи и скорости хим. реакций в тяжёлой воде. Связи, образованные атомами углерода с дейтерием прочнее, чем СН-связи из-за того, что амплитуда колебания дейтерона, имеющего в два раза большую чем протон массу, меньше амплитуды колебания протона в аналогичной связи и тем самым, это стабилизирует связь.
Другое важное свойство определяется самой пространственной структурой тяжёлой воды, которая имеет тенденцию сближать гидрофобные группы макромолекулы, чтобы минимизировать их эффект на водородную (дейтериевую) связь в присутствии молекул тяжёлой воды. Поэтому структура спирали, каковой является ДНК в присутствии тяжёлой воды стабилизируется. Кроме этого, отмечены радиопротекторные свойства тяжёлой воды на клетки печени животных, в которой экспонировались эти клетки. Также было показано, что жизненный цикл плоских червей, выращенных на тяжёлой воде увеличивается примерно в 1,5 раза по-сравнению с червями, выращенными на обычной воде (М. Шепенинов, 2006).
Вероятно, клетка реализует лабильные адаптивные механизмы, которые способствуют функциональной реорганизации работы жизненно-важных систем в тяжёлой воде (О. В. Мосин, 1996). Так, нормальному биосинтезу и функционированию в тяжёлой воде таких биологически активных соединений, как нуклеиновые кислоты и белки способствует поддержание их структуры посредством формирования водородных (дейтериевых) связей в молекулах. Связи, сформированные атомами дейтерия различаются по прочности и энергии от аналогичных водородных связей. Различия в нуклеарной массе атома водорода и дейтерия косвенно могут служить причиной различий в синтезах нуклеиновых кислот, которые могут приводить в свою очередь к структурным различиям и, следовательно, к функциональным изменениям в клетке. Ферментативные функции и структура синтезируемых белков также изменяются при росте клеток на тяжёлой воде, что может отразиться на процессах метаболизма и деления клетки.
Отмечено, что адаптация к тяжёлой воде проходит легче при постепенном увеличении содержания дейтерия в среде, так как чувствительность к тяжёлой воде разных ключевых систем различна (О. В. Мосин, 1996). Практически даже высокодейтерированные среды содержат протоны от 0,2—10%. Возможно, что остаточные протоны в момент адаптации к тяжёлой воде облегчают перестройку к изменившимся условиям, встраиваясь в те участки, которые наиболее чувствительны к замене на дейтерий. Если допустить это, то встраивание протонов должно приводить к накоплению легкого изотопа в органическом материале клеток и соответственно к обогащению тяжелым изотопом среды культивирования.
Адаптация к тяжёлой воде является фенотипическим феноменом, поскольку адаптированные к тяжёлой воде клетки возвращаются к нормальному росту в протонированных средах после некоторого лаг-периода (О.В. Мосин с соавт., 1996). В то же время обратимость роста на Dи Н-средах не исключает возможности изменения метаболизма дейтерированных клеток, т.е. морфологической и функциональной перестройки в тяжёловодородной среде. Электронная микроскопия дейтерированных клеток бактерий Micrococcus lysodeikticus (В. А. Ерёмин, Л. Н. Чекулаева, 1978) выявила существенные различия в морфологии выращенных на тяжёлой воде клеток (рисунок 4). Клетки, выращенные на тяжёлой воде имели в 2—3 раза более толстую клеточную стенку; чем протонированные клетки, распределение в них ДНК было неравномерным (В. А. Ерёмин, Л. Н. Чекулаева, 1978). На микрофотографии дейтерированных клеток Micrococcus lysodeikticus видны как плотные (одинарная стрелка), так и электронно-прозрачные участки (двойная стрелка), состоящие из плотно упакованных мембран, наподобие мезосом. Кроме того, для дейтерированного микроорганизма (рисунок 4, в) было также характерно резкое изменение формы клеток и направления их деления с образованием сложных структур, состоящих из 6—8 клеток. По наблюдениям авторов, клеточное деление не заканчивалось обычным расхождением дочерних клеток, а приводило к образованию атипичных клеток—«монстров», описанных Мозесом с соавт. (Moses et al., 1958).
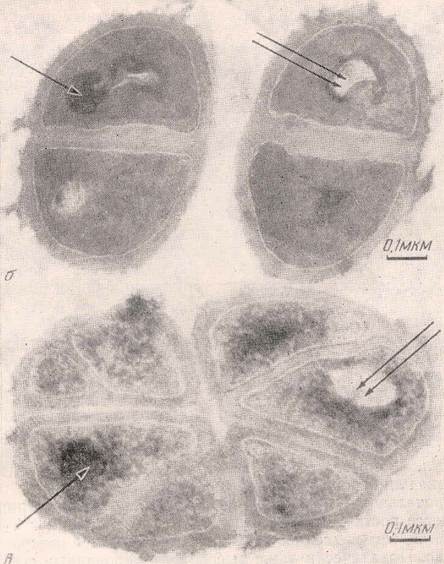
Рис. 4. Электронные микрофотографии клеток бактерий Micrococcus lysodeikticus; б – клетки, выращенные на протонированной среде, в – дейтерированные клетки, выращенные на тяжёловодородной среде (по данным В. А. Ерёмина и Л. Н. Чекулаевой, 1978 ).
Вероятно, наблюдаемые морфологические изменения на тяжёлой воде связаны с ингибированием роста дейтерированных клеток и обусловлены перестройкой в процессе адаптации к тяжёлой воде. Факт, что дейтерированные клетки более крупные, чем протонированные является общебиологическим и наблюдается при выращивании целого ряда животных и растительных объектов (Мосин О. В., 1996).