Биостатические эффекты тяжёлой воды в биологических объектах
О. В. МОСИН, Д.А. СКЛАДНЕВ, В.И. ШВЕЦ.
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571, Москва, просп. Вернадского, д. 86.
Изотоп водорода дейтерий, содержащий в своём ядре один нейтрон, распространённый в природе (природная распространённость дейтерия составляет 0.015%) в виде тяжёлой воды, был открыт в 1939 году.
Сразу после открытия этого изотопа учёные начали проводить исследования связанные с ростом клеток на тяжёлой воде, которые привели их к неожиданным результатам. Тяжёлая вода отличается от обычной воды молекулярной массой. В молекуле тяжёлой воды в отличие от обычной воды вместо двух атомов водорода, связанных ковалентной связью с атомом кислорода в молекуле эти два атома водорода замещены на дейтерий. Основной вывод, сделанный учёными был таков - максимальные концентрации тяжёлой воды несовместимы с жизнью и приводят к гибели клетки.
Тяжёлая вода ингибирует жизненно-важные функции роста и развития многих микроорганизмов [1]. Некоторые бактерии выносят 70%-ную и выше концентрацию тяжёлой воды в среде [2], в то время как растительные клетки могут нормально развиваться при концентрациях тяжёлой воды не более 50-75% [3], а клетки животных не более 35% тяжёлой воды [4]. Однако, впоследствии было показано, что несмотря на биостатический эффект тяжёлой воды на клетку, многие клетки бактерий, растений и животных могут быть адаптированы к тяжёлой воде.
Какова же природа этого интересного биологического феномена - адаптации клетки к тяжёлой воде и какова роль биологически важным макромолекул-белков и дезоксирибонуклеиновых кислот в этом процессе?
В процессе роста клеток на тяжёлой воде в них синтезируются макромолекулы, в которых атомы водорода в углеродном скелете полностью замещены на дейтерий. Такие дейтерированные макромолекулы претерпевают адаптационные модификации, необходимые для нормального функционирования клетки в тяжёлой воде. Но эти изменения не единственны; физиология, морфология, цитология клетки, а также генетический аппарат клетки также подвергается воздействию и модификации в тяжёлой воде.
Присутствие дейтерия в биологических системах приводит к изменениям структуры и свойствам жизненно-важных макромолекул таких как дезоксирибонуклеиновые кислоты (ДНК) и белки. При этом различают первичные и вторичные изотопные эффекты дейтерия в зависимости от того, какое положение занимает атом дейтерия в молекуле.
Наиболее важными для структуры макромолекулы связи являются водородные (дейтериевые) связи. Они формируются между соседними атомами дейтерия (водорода) и гетероатомами кислорода, углерода, азота, серы и т.д. и играют главную роль в определении структуры макромолекулярных цепей и как эти структуры взаимодействуют с другими соседними макромолекулярными структурами, а также с тяжелой водной окружающей среды.
Другое важное свойство определяется самой пространственной структурой тяжёлой воды, которая имеет тенденцию сближать гидрофобные группы макромолекулы, чтобы минимизировать их эффект на водородную (дейтериевую) связь в присутствии молекул тяжёлой воды.
Конформация двойной спирали макромолекулы ДНК и макромолекул белков изменяются в присутствии тяжёлой воды так, чтобы макромолекулы обычных белков, помещённые в тяжелую воду имеют более устойчивую пространственную структуру за счёт вторичных изотопных эффектов тяжёлой воды [1]. Вероятно, именно поэтому тяжёлая вода проявляет стабилизирующий эффект на пространственную структуру спирали макромолекул посредством формирования многочисленных непостоянных маложивущих легкообмениваемых на водород (дейтерий) водородных связей с карбоксильными, карбонильными, гидроксильными, сульфидными и амино группами макромолекул. В то время как ковалентные связи атома дейтерия с водородом С-2Н могут синтезироваться в молекулах только de nоvo, т.е. в процессе биосинтеза. И эти связи приводят к дестабилизации дейтерированных молекул.
Серьезное изменение в биохимии клетки связано в её способности делиться в присутствии тяжёлой воды. Тяжёлая вода замедляет скорость деления клетки (митоз) в стадии профазы и особенно этот эффект выражен для быстро делящихся клеток. Этот эффект пропорционален концентрации тяжёлой воды в среде [2].
Способность к адаптации к тяжёлой воде у разных родов и видов бактерий различная и может варьировать в пределах таксономической группы [3]. По-видимому, адаптация к тяжёлой воде определяется как таксономической специфичностью организмов, так и особенностями их метаболизма, функционированием различных путей ассимиляции субстратов, а также эволюционной нисшей, которую занимает исследуемый объект. При этом чем ниже уровень эволюционного развития организма, тем лучше он приспосабливается к присутствию дейтерия в среде. Для всех организмов рост на тяжёлой воде сопровождался снижением ростовых характеристик [4-7].
По-видимому, адаптация к тяжёлой воде является фенотипическим явлением, поскольку адаптированные к тяжелой воде клетки возвращаются к нормальному росту в средах с обычной водой после некоторого лаг-периода. Метаболизм адаптированных клеток не претерпевает существенных изменений в тяжёлой воде. В то же время эффект обратимости роста на водно/тяжёловодородных средах теоретически не исключает возможности того, что этот признак стабильно сохраняется при росте в воде, но маскируется при переносе клеток на тяжёлую воду.
Серьезное изменение в биохимии клетки связано в её способности делиться в присутствии тяжёлой воды. Тяжёлая вода замедляет скорость деления клетки (митоз) в стадии профазы и особенно этот эффект выражен для быстро делящихся клеток. Этот эффект пропорционален концентрации тяжёлой воды в среде [8] .
При росте клеток на тяжёлой воде играет немаловажную роль состав среды выращивания. При этом не исключено, что при проведении адаптации на минимальных средах, содержащих тяжёлую воду образуются формы бактерий, ауксотрофные по определенным ростовым факторам, например аминокислотам, и вследствие этого бактериальный рост ингибируется.. Возможно поэтому объясняется тот факт, что адаптация к тяжёлой воде происходит лучше всего на комплексных средах, содержащих широкий набор ростовых факторов и аминокислот, компенсирующих потребность бактерий в этих соединениях.
Можно предположить, что клетка реализует лабильные адаптивные механизмы, которые способствуют функциональной реорганизации работы жизненно-важных систем в тяжёлой воде. Так, например, нормальному биосинтезу и функционированию в тяжёлой воде таких биологически активных соединений, как нуклеиновые кислоты и белки способствует поддержание их структуры посредством формирования водородных (дейтериевых) связей в молекулах. Связи, сформированные атомами дейтерия различаются по прочности и энергии от аналогичных водородных связей. Различия в нуклеарной массе атома водорода и дейтерия косвенно могут служить причиной различий в синтезах нуклеиновых кислот, которые могут приводить в свою очередь к структурным различиям и, следовательно, к функциональным изменениям в клетке.
Ферментативные функции и структура синтезируемых белков также изменяются при росте клеток на тяжёлой воде, что может отразиться на процессах метаболизма и деления клетки. Некоторые исследователи сообщают, что после обратного изотопного (1Н-2H)-обмена ферменты не прекращают своей функции, но изменения в результате изотопного замещения за счет первичного и вторичного изотопных эффектов, а также действие тяжёлой воды как растворителя (большая структурированность и вязкость по сравнению с обычной водой) приводили к изменению скоростей и специфичности ферментативных реакций в тяжёлой воде [9-10].
Клетки животных, выращенные на 30%-ной тяжёлой воде содержали больше липидов, чем клетки полученные при росте на обычной воде [2]. Клетки, полученные на тяжёлой воде содержат больше сквалена, стирольных эфиров, триглицеридов жирных кислот и нейтральных жиров, чем клетки выращенные на обычной воде. Но самым интересным явлением было то, что дейтерированные клетки, полученные с тяжёлой воды были более устойчивы к действию радиации, чем обычные клетки.
Структурно-динамические свойства клеточной мембраны, которые в большинстве зависят от качественного и количественного состава липидов, также могут изменяться в присутствии тяжёлой воды. Так, сравнительный анализ липидного состава дейтерированных клеток B. subtilis, полученных при росте на тяжёлой воде показал различия в количественном составе мембранных липидов по сравнению с обычной водой (рисунок). Примечательно, что в образце полученном с тяжёлой воды соединения, имеющие времена удерживания - 33.38; 33.74 и 33.2 мин не детектируются (рисунок 1). Полученный результат, по видимому, объясняется тем, что клеточная мембрана является одной из первых органелл клетки, которая испытывает воздействие тяжёлой воды, и тем самым компенсирует реалогические параметры мембраны (вязкость, текучесть, структурированность) изменением количественного состава липидов.
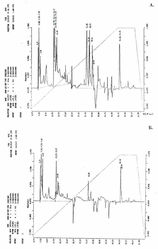
В общих чертах, при попадании клетки в дейтерированную среду из неё не только исчезает протонированная вода за счет реакции обмена вода-тяжёлая вода, но и происходит очень быстрый изотопный (1Н-2H)-обмен в гидроксильных, карбоксильных, сульфгидрильных и аминогруппах всех органических соединений, включая нуклеиновые кислоты, липиды, белки и сахара. Известно, что в этих условиях только С-Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С-2H могут синтезироваться de novo [11].
Кроме вышеобозначенных эффектов, возможное изменение соотношения основных метаболитов в процессе адаптации к тяжелой воде также может негативно сказываться на рост клетки.
Также не исключено, что эффекты, наблюдаемые при адаптации к тяжёлой воде связаны с образованием в тяжёлой воде конформаций молекул с иными структурно-динамическими свойствами, чем конформаций, образованных с участием водорода, и поэтому имеющих другую активность и биологические свойства. Так, по теории абсолютных скоростей разрыв С2H-связей может происходить быстрее, чем СH-связей, подвижность иона 2H+ меньше, чем подвижность Н+, константа ионизации тяжёлой воды несколько меньше константы ионизации обычной воды [12].
Суммируя полученные данные, можно сделать вывод, что чувствительности различных клеточных систем к тяжёлой воде отличны. С точки зрения физиологии, наиболее чувствительными к замене Н+ на 2H+ могут оказаться аппарат биосинтеза макромолекул и дыхательная цепь, т. е., именно те клеточные системы, которые используют высокую подвижность протонов и высокую скорость разрыва водородных связей.
Список литературы:
1. Crespi H. L. Biosynthesis and uses of per-deuterated proteins. in: Synt. and Appl. of Isot. Label. Compd. // Ed. R. R. Muccino. - Elsevier. - Amsterdam, 1986 - P. 111-112.
2. Katz J, Crespi H.L. // Pure Appl. Chem. - 1972. - V.32. - P. 221-250.
3. Daboll H. F., Crespi H. L., Katz J. J. // Biotechnology and Bioengineering. - 1962. - V. 4. - P. 281-297.
4. Мосин О. В., Карнаухова Е. Н., Пшеничникова А. Б., Складнев Д. А., Акимова О. Л. // Биотехнология. - 1993. - N 9. - С. 16-20.
5. Мосин О. В., Складнев Д. А., Егорова Т. А., Юркевич А. М., Швец В. И. // Биотехнология. - 1996. - N 3. - С. 3-12.
6. Мосин О. В., Складнев Д. А., Егорова Т. А., Юркевич А. М., Швец В. И. // Биотехнология. - 1996. - N 4. - С. 27-35.
6. Складнев Д. А., Мосин О. В., Егорова Т. А., Ерёмин С. В., Швец В. И. // Биотехнология. - 1996. - N 5. - С. 25-34.
7. Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. // Биоорганическая химия. - 1996. - Т. 22. - N 10-11. - С. 856-869.
8. 4. Crespy H. L. Stable Isotopes in the Life Sciences. - International atomic energy agency. - Vienna. - 1977. - P. 111-121.
9. Barksdale A. D., Rosenberg A. // Methods Biochem. Anal. - 1982. - V. 28. - P. 1-25.
10. Tuchsen E., Woodward C. K. // J. Mol. Biol. - 1985. - V. 185. - P. 421-430.
11. Perrin C. L., Arrhenius G. M. L. // J. Am. Chem. Soc. - 1982. - V. 104. - P. 6693-6699.
12. Covington A. K., Robinson R. A., Bates R. G. // J. Phys. Chem. - 1966. - V. 70. - P. 3820-3829