Генно-инженерные методы получения изотопномеченных аминокислот и белков
Осуществлять направленное биосинтетическое получение индивидуальных белков, меченных стабильными изотопами удобно за счёт использования векторов экспрессии нужных генов, ответственных за биосинтез того или иного интересующего исследователей белка. Оправдано и целесообразно использование для этих целей векторов экспрессии на основе плазмидной ДНК бактерии E. coli, например, вектор экспрессии Т4 лизоцима, включающий в своем составе плазмиду pHSe5 [118]. В результате использования этого вектора экспрессии, были получены миллиграммовые количества Т4-лизоцима, селективно меченного стабильными изотопами азота 15N или углерода 13C. Включение стабильных изотопов в данном случае удалось осуществить за счет роста генного конструкта E. coli на средах, содержащих [15N]или [13С]аминокислоты. Метод также может применяться для получения индивидуальных меченых белков, экспрессия которых происходит в системах, отличных от E. coli, например, системы экспрессии на основе клеток насекомых или млекопитающих [119].
Другие микробные системы, в которых белки экспрессируются с высокими выходами, также могут быть пригодны для получения изотопномеченых аналогов белков. К ним относятся, прежде всего такие хорошо изученные биологические объекты, как дрожжи, бактерии и бактериофаги. Так, за счёт использования вышеперечисленных микробных объектов в качестве векторов экспрессии были получены препаративные количества индивидуальных очищенных [15N]белков: нуклеаза стафилококка [120], интерлейкин 1 [121], белок репрессор фага P22C2 [122], тиредоксин E. coli [123], гемоглобин [124], -протеаза [125], ингибитор субтилизина [126], репрессор фага [127], и белок человеческого фактора роста N-ras P21 [128].
В работе [129] описан метод получения индивидуальных [2H]белков с использованием вектора экспрессии на основе штамма облигатных метилотрофных бактерий Methylobacillus flagellatum. Метод состоит в том, что в метилотрофах клонируют структурный ген исследуемого белка. Таким методом можно получать, например, [2H]-интерфероны, хорошо экспрессируемые в клетках метилотрофов, либо другие интересующие исследователей белки. Метод также позволяет вводить в молекулы аминокислот и белков другие стабильные изотопы, например, 13С. В связи с этим следует подчеркнуть, что основным недостатком при использовании полученных данным методом [13C]аминокислот в ЯМР-исследованиях являются всё же недостаточно высокие уровни изотопного обогащения аминокислот, что обусловливает усложнение спектров ЯМР за счет 12C13C-спин-спинового взаимодействия между близлежащими атомами углерода в молекуле [130]. Так как мультиквантовые резонансы близлежащих атомов углерода в молекуле являются основным препятствием для интерпретации спектров ЯМР, необходимо применять усовершенствованные методы получения [13C]аминокислот, позволяющие лимитировать процесс разбавления метки. Так, в последнее время были генетически сконструированы новые штаммы бактерий, которые несут мутации по генам метаболизма определенного круга предшественников этих аминокислот [131]. Это позволяет избежать разбавления метки при росте микроорганизма на среде, содержащей те или иные меченые субстраты за счет ингибирования биосинтеза аминокислот de novo у данных мутантных штаммов бактерий.
При выборе определенных мутаций по генам метаболизма стремятся удовлетворить как миниум двум условиям для нормального функционирования подобных генетически сконструированных систем, чтобы, во-первых, по возможности снизить деградацию метки или ее разбавление в процессе внутриклеточного синтеза немеченых предшественников de novo и во-вторых, свести к минимуму процессы перестройки меченых положений углеродного скелета молекулы за счет биосинтеза одинаковых интермедиантов, образующихся по сопряжённым путям биосинтеза. Данная стратегия реализована в работе [132], где сообщается о получении двух генетически сконструированных штаммов бактерий, обозначенных как E. coli DL10 и E. coli DL11, которые несли геномные делеции, исключающие обмен атомов углерода между интермедиаторами в процессе гликолиза и в цикле трикарбоновых кислот.
За счёт использования данных штаммов удалось получить препаративные количества [13C]аминокислот с уровнями изотопного обогащения до 95%. Схема, иллюстрирующая мутации в генах метаболизма в цикле гликолиза и трикарбоновых кислот, приведена на рис. 2. Оба сконструированных штамма бактерий E. coli имели в геноме мутации, затрагивающие гены семи ферментов основных путей метаболизма (рис. 2).
Ферменты (1-5) у штамма E. coli DL10 были инактивированы за счёт мутаций, вследствие чего он ассимилировал в качестве источников углерода и энергии сукцинат и ацетат из ростовой среды, а [1-13C]лактат добавляли в ростовую среду для компенсации метаболических потребностей клетки и для введения 13C-метки в молекулы аминокислот, синтезируемых в процессе гликолиза.
Другой штамм бактерий E. coli DL11 мог утилизировать немеченую глюкозу в качестве источников углерода и энергии по гликолитическому пути ассимиляции углерода, в то время как [1,4-13C]cукцинат и [1-13C]ацетат добавляли в ростовую среду для того, чтобы стимулировать биосинтез [13C]аминокислот, образующихся по циклу трикарбоновых кислот. Кроме того, в этом случае было необходимо ввести в бактериальный геном дополнительную мутацию, связанную c геном -кетоглутаратдегидрогеназы, чтобы минимизировать процесс деградации метки в цикле трикарбоновых кислот.
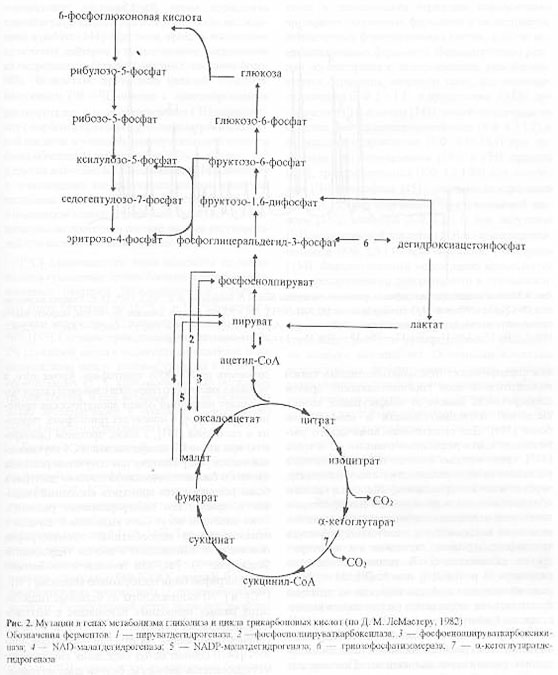
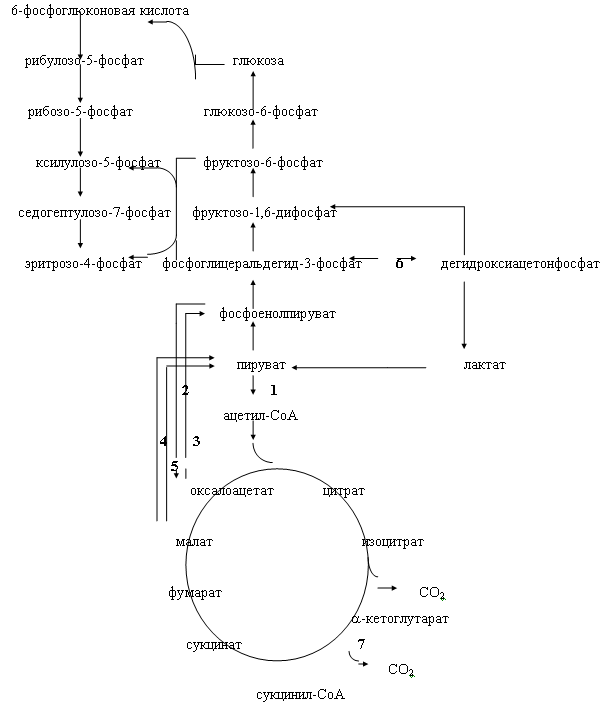
Рис. 2. Мутации в генах метаболизма цикла гликолиза и трикарбоновых кислот (по ЛеМастеру Д. М., 1982).
Обозначения ферментов: 1 - пируватдегидрогеназа; 2 - фосфоенолпируваткарбоксилаза; 3 - фосфоенолпируваткарбоксикиназа; 4 - NAD-малатдегидрогеназа; 5 - NADP-малатдегидрогеназа; 6 - триозофосфатизомераза; 7 - альфа-кетоглутаратдегидрогеназа.