Мосин Олег Викторович
Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов, меченных 2Н (D) И 13С, с высокими степенями изотопного обогащения.
03.00.23-Биотехнология
Автореферат диссертации на соискание учёной степени кандидата химических наук
Москва -1996

Научные руководители:
доктор химических наук, профессор, член корреспондент РАМН, В. И. ШВЕЦ, кандидат биологических наук, старший научный сотрудник Д. А. СКЛАДНЕВ.
Официальные оппоненты:
доктор химических наук, профессор Н. Ф. МЯСОЕДОВ.
кандидат химических наук, ведущий научный сотрудник Б. М. ПОЛАНУЕР.
Ведущая организация:
Государственный научно-исследовательский институт биосинтеза белковых веществ "ГОСНИИСИНТЕЗБЕЛОК".
Защита диссертации состоялась 24 мая 1996 г в 15.00 на
заседании Диссертационного совета Д 063. 41. 01 в Московской Государственной академии тонкой химической технологии им. М. В. Ломоносова по адресу: 1S7571, Москва, пр-т Вернадского, дом 86.
С диссертацией можно ознакомиться в библиотеке Московской Государственной академии тонкой химической технологии им. М. В. Ломоносова по адресу: 119831, Москва, ул. Малая Пироговская, дом 1.
Автореферат разослан:_____ апреля 1996 г
Учёный секретарь Диссертационного Совета,
Кандидат химических наук, старший научный сотрудник
А. И. Лютик
Общая характеристика работы
Актуальность работы. В настоящее время во всем мире растет интерес к природным соединениям, меченным стабильными изотопами, в частности дейтерием (D) и углеродом 13С, которые незаменимы для разнопрофильных биомедицинских и диагностических целей, структурно-функциональных исследований, а также для изучения клеточного метаболизма разнообразных биологически активных соединений (БАС) с использованием стабильных изотопов.
Тенденции к применению стабильных изотопов по сравнению с их радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекуле методами высокого разрешения: спектроскопией ядерного ЯМР, ИК- и лазерной спектроскопией, масс-спектрометрией. Развитие этих современных методов за последние годы позволило усовершенствовать проведение многочисленных биологических исследований de novo, а также изучать структуру и механизм действия клеточных БАС на молекулярном уровне. Зачастую для данных исследований необходимо, чтобы молекулы синтезируемых БАС имели как можно более высокие степени изотопного обогащения.
Именно поэтому разработка путей биосинтетического получения БАС с высокими степенями изотопного обогащения является очень актуальной задачей для современной биотехнологии и отечественной микробиологической промышленности. С развитием новых биотехнологических подходов в последнее время появилась возможность получать разнообразные стабильно меченые соединения за счёт биологической конверсии сравнительно дешёвых дейтерированных субстратов дейтерометанола и тяжёлой воды (CD3OD/D2O) в генетически сконструированных штаммах бактерий (О.В. Мосин, Д.А. Складнев). Однако опробированные в лабораторных условиях процессы редко применяются в биотехнологии из-за наличия ряда трудностей, связанных с клеточной адаптацией к тяжёлой воде (D2O).
Явление адаптации к тяжёлой воде интересно не только с научной точки зрения, но оно также позволяет получать уникальный биологический материал, очень удобный для решения задач молекулярной организации клетки с помощью метода ЯМР-спектроскопии. Вышеперечисленные данные послужили основой для выбора объектов исследования в наших экспериментах. Ими являлись генетически маркированные штаммы-продуценты аминокислот, белков и нуклеозидов, относящиеся к различным таксономическим родам микроорганизмов: факультативные метилотрофные бактерии Brevibacterium meihylicurn, облигатные метилотрофные бактерии Methylobactllus flagettatum, галобактерии Halobacterium halobium и хемогетеротрофные бактерии Bacillus subtilis и Bacillus amyloliquefaciens.
Настоящая работа выполнена на кафедре биотехнологии МГАТХТ им. М.В. Ломоносова в рамках научно-технической программы Наукоёмкие химические технологии.
Целью данной работы была разработка методов биотехнологического получения молекул аминокислот, белков и нуклеозидов, меченных дейтерием и изотопом углерода 13С с высокими степенями изотопного обогащения.
Поскольку биосинтетический потенциал исследуемых штаммов за счёт конверсии тяжёлой воды к началу проведения данной работы был изучен недостаточно, в рамках работы представляло интерес исследование принципиальной возможности их адаптации к росту на средах содержащих тяжёлую воду для синтеза меченных целевых продуктов. Для этого были разработаны специальные биотехнологические подходы по получению меченных БАС, что позволило подойти к реализации комплексного использования химических компонентов биомассы полученных штаммов-продуцентов и созданию новых безотходных микробиологических производств по получению изотопно-меченных БАС на их основе.
Научная новизна работы заключается в следующих аспектах:
- Предложен метод получения штаммов-продуцентов БАС, устойчивых к максимальным концентрациям тяжёлой воды в ростовой среде.
- Показана перспективность использования суммарных химических компонентов биомассы метилотрофных бактерий Brevibacterium methylicum, полученных в результате многоступенчатой адаптации к тяжёлой воде для биосинтеза дейтерий-меченных молекул аминокислот, белков и нуклеозидов.
- Разработаны методы получения изотопно-меченных молекул БАС, основанные на использовании высокоактивных штаммов-продуцентов, адаптированных к росту и биосинтезу на средах с высокими концентрациями тяжёлой воды. Получены с высокими выходами индивидуальные дейтерий- и 13С-меченые аминокислоты – аланин, валин, лейцин/изолейцин и фенилаланин (степени изотопного включения в молекулы составляют до 97,5% от общего количества атомов водорода в молекуле); [1,3',4',2,8-D5]-инозин (степень включения дейтерия в молекулу 62,5% от общего количества атомов водорода в молекуле) и дейтерий-меченный трансмембранный белок бактериородопсин с селективным и униформным характером включения метки в молекуле.
- Разработаны общие принципы масс-спектрометрического анализа степеней изотопного обогащения мультикомпонентных смесей аминокислот при данном способе введения метки за счёт применения прямой обработки (дериватизации) культуральной жидкости и белковых гидролизатов дансилхлоридом/карбобензоксихлоридом и диазометаном.
Практическая значимость: Полученные в работе результаты могут быть использованы для создания новых безотходных производств по синтезу изотопно-меченных молекул БАС. В частности, основанных на использовании биологической конверсии дешёвых меченных низкомолекулярных субстратов в дорогостоящие клеточные БАС.
На способ получения униформно-меченного дейтерием L-Phe имеется положительное решение ВНИИГПЭ о выдаче авторского свидетельства № 055610 от 17.11.1995 г на заявку № 930558240 от 15.12.1993 г. На способ получения [1,2',41,2,8-D5]-инозина оформлена заявка № 95118778 от 14.11.1995 г.
Положения, выносимые на защиту:
- Подбор условий получения биомассы штамма факультативных метилотрофных бактерий Brevibacterium methylicum с униформным характером мечения молекул клеточных БАС дейтерием. Использование гидролизатов дейтеро-биомассы данного штамма для биосинтеза дейтсрий-меченного инозина и бактериородопсина.
- Методы получения D- и 13С-аминокислот, [1',3',4',2,8-D5]инозина и бактериородопсина за счёт биологической конверсии СD3ОD/13СН3ОН и D2O.
- Метод прямой химической модификации интактных культуральных жидкостей дансиллхлоридом/карбобензоксихлоридом и диазометаном. Применение данного метода для масс-спектрометрического анализа степеней изотопного обогащения молекул аминокислот в составе мультикомпонентных смесей при данном способе введения изотопной метки в молекулы.
Апробация. Материалы диссертационной работы докладывались и обсуждались на 3-м международном конгрессе по аминокислотам, пептидам и их аналогам (Вена, август, 1993), на 4-й Всероссийской научной конференции "Проблемы теоретической и экспериментальной химии" (Екатеринбург, апрель, 1994), 6-й международной конференции по ретинальным белкам (Ляйден, июнь, 1994), 7-м международном симпозиуме по генетике промышленных штаммов микроорганизмов (Монреаль, июль, 1994), 8-м международном симпозиуме по микробному росту на C1-соединениях (Сан-Диего, август, 1995), Евроазийском симпозиуме по современным направлениям в биотехнологии (Анкара, ноябрь, 1995).
Публикации. По материалам диссертационной работы опубликовано девять печатных работ и шесть тезисов научных конференций.
Структура работы. Диссертация состоит из введения, обзора литературы, экспериментальной части, результатов, выводов. Работа изложена на 120 страницах машинописного текста, содержит 17 рисунков и 15 таблиц.
Материалы и методы
Бактериальные штаммы и питательные среды. Исследования проводили с генетически маркированными штаммами-продуцентами аминокислот, белков и нуклеозидов:
Штамм №l. – Brevibacterium methylicum ВКПМ В 5652 (leu), штамм факультативных метилотрофных бактерий, продуцент L-фенилаланина.
Штамм №2. – Methylobacillus flagellatum КТ (ile), штамм облигатных метилотрофных бактерий, продуцент L-лейцина.
Штамм №3. – Bacillus subtilis (his, tyr, ade, иrа), штамм хемогетеротрофных бактерий, продуцент инозина.
Штамм №4. – Bacillus amyloliquefacien (ade, иrа), штамм хемогетеротрофных бактерий, продуцент тимидина.
Штамм №5. – Halobacterium halobium ET 1001, пигментсодержащий штамм экстремальных фотоорганогетеротрофных галобактерий, синтезирующих трансмембранный белок бактериородопсин.
В работе использовали следующие питательные среды:
- Минимальная среда М9 (Miller J., 1976). Среду использовали для ферментации штаммов №1 и №2 и выделения отдельных колоний в условиях адаптации к D2O.
- Комплексная ферментационная среда (ФМ-среда) (Казаринова Л.А, 1980). Среду использовали для ферментации штаммов №3 и №4.
- Синтетическая среда TS (Gibson Т., 1962). Среду использовали для ферментации штамма №5.
Условия адаптации и культивирования бактерий на дейтерий-содержащих средах. Адаптацию клеток к дейтерию проводили на твёрдых агаризованных средах (2 %-ный агар) с тяжелой водой. При этом использовали как простой рассев культур до отдельных колоний на средах, приготовленных из 99,9 ат.% D2O, так и многостадийную адаптацию бактерий на средах, содержащих ступенчато увеличивающиеся концентрации D2O.
Для биосинтеза меченных БАС использовали среды тех же составов, приготовленные на основе тяжёлой воды и дейтерометанола (D2О/СD3ОD) с использованием безводных реагентов. Полученную таким образом биомассу В. mehylicum гидролизовали в 1 н. DCl и использовали в качестве источника суммарных ростовых факторов для культивирования штаммов №3 и №5 соответственно.
13С-аминокислоты были получены за счёт конверсии 13СН3ОН в метилотрофных бактериях M. flagellatum.
Для введения дейтерия в молекулу бактериородопсина использовали синтетическую среду TS, в которой ароматические аминокислоты – L-Phe, L-Tyr и L-Тrр были замещены их дейтерированными аналогами – L-[2,3,4,5,6-D5]-Phe, L-[3,5-D2]-Tyr и L-[2,4,5,6,7-D5]-Trp.
Методы выделения и анализа изотопно-меченых БАС. Экстракцию липидов проводили смесью хлороформ–метанол (2:1) по методу Блайера и Дайера (Bligh E.G., Dyer W.J, 1959).
Определение содержания глюкозы в культуральной жидкости проводили глюкозооксидазным методом (Beyrich Т., 1965).
Бактериородопсин выделяли из пурпурных мембран Н. halobium ET 1001 по модифицированному методу Остерхельда и Стохениуса (Oesterhdt О., Stohenius, 1976).
Гидролиз белка проводили с использованием 4 н. Ва(ОН)2 и 6 н. DCl ( в D2О) (110 °С, 24 ч).
N-Cbz-производные аминокислот получали в ходе реакции Шоттена-Баумана (GreensteinJ., Winitz M., 1961).
N-Dns-производные аминокислот получали по методу Греема и Хартли (GreemB., Hartly В, 1963).
Метиловые эфиры N-Dns-аминокислот получали по методу Физера (Fiser J., 1963).
Аналитическое и препаративное разделение N-Cbz-производных аминокислот проводили методом ОФ ВЭЖХ, разработанным Егоровой Т.А. (Егорова Т.А., 1993).
Разделение метиловых эфиров N-Dns-аминокислот проводили на жидкостном хроматографе Кпаие
r (ФРГ), снабженным УФ-детектором и интегратором C-R 3А (Shirnadzu, Япония). Неподвижная фаза: Separon SGX С 18,1 мкм, 150×3,3 мм (Kova, Чехословакия). Использовали градиентное элюирование растворителями: (А) – ацетонитрил–трифторуксусная кислота (20:80 об/об) и (В) – ацетонитрил (от 20% В до 100% В 30 мин, при 100% В 5 мин, от 100% В до 20% В 2 мин, при 20% В 10 мин),
Ионнообменную хроматографию проводили па приборе Biotronic LC 5001 (ФРГ), 230×3,2 мм, рабочее давление – 50–60 атм, скорость подачи буфера – 18,5 мл/ч, нингидрина – 9,25 мл/ч, детекция при 570 нм и 440 нм.
Масс-спектры электронного удара (ЭУ) получены на приборе МВ-80А
(Hitachi, Япония) при энергии ионизирующих электронов 70 эВ. Масс-спектры FAB получены на приборе MBA
(Hitachi, Япония) при ионном токе 0,6–0,8 мА.
Результаты и обсуждение.
1. Получение штаммов-продуцентов бас, адаптированных к росту и биосинтезу на средах с максимальными концентрациями тяжёлой воды.
Адаптация облигатных метилотрофных бактерий М. flagellatum. В связи с важностью препаративного аспекта получения дейтерий-меченных соединений в рамках данной работы была изучена возможность адаптации различных штаммов-продуцентов БАС к росту на средах с максимальными концентрациями тяжелой воды. Для этого были проверены представители различных таксономических групп метилотрофных бактерий, имеющихся в коллекции ГосНИИ Генетики: L-лейцин-продуцирующий штамм облигатных метилотрофных бактерий М. flagellatum (ileu), реализующий 2-кето-3-дезокси-6-фосфогдюконат-альдолазный (КДФГ) вариант рибулёзо-5-монофосфатного (РМФ) цикла ассимиляции углерода и L-фенилаланин-продуцирующий штамм факультативных метилотрофных бактерий В. methylicum (leu), ассимилирующий метанол по РМФ-циклу.
Для проведения адаптации был выбран ступенчатый режим увеличения концентрации тяжёлой воды в ростовых средах, так как мы предположили, что постепенное привыкание организма к тяжёлой воде будет оказывать благоприятный эффект на параметры микробного роста. При этом штамм М. flagellatum обнаружил повышенную чувствительность к тяжёлой воде: ингибирование роста бактерий наблюдалось при концентрациях D2О в среде 74,5 об.%. Данный штамм метилотрофных бактерий удалось адаптировать только к 74,5 об.% D2О. В связи с этим, в экспериментах по изучению уровней включения дейтерия в аминокислоты использовали образцы культуральной жидкости и биомассы М. flagellatum, полученные со среды, содержащей 74,5 об.% D2O. Концентрация CD3OD в среде культивирования составляла 1 об.%.
Адаптация факультативных метилотрофных бактерий В. methylicum. Попытки адаптировать штамм В. methylicum к росту при сохранении способности к биосинтезу L-фенилаланина на максимально дейтерированной среде с 98 об.% D2O и 2 об.% СD3OD привели к желаемому результату. К данному штамму метилотрофных бактерий был применён специально разработанный нами подход по адаптации, который заключался в серии из пяти адаптационных рассевов исходной культуры на агаризованных средах (с добавкой 2 об.% CD3OD) при ступенчатом увеличении концентраций тяжёлой воды (от 0; 24,5; 49,0; 73,5 об% до 98 об% D2O) и последующей селекции устойчивых к тяжёлой воде колоний бактерий. При этом последовательно отбирали отдельные колонии, выросшие на средах, содержащих тяжёлую воду. Затем их пересевали на среды с большей степенью дейтерированпости, включая среду с 98 об.% D2O (степень выживаемости бактерий на конечной полностью дейтерированной среде составляет не более 40%).
Полученный результат в опытах по адаптации В. methylicum к тяжёлой воде, позволил использовать гидролизаты его биомассы, а также саму биомассу, полученную в ходе многоступенчатой адаптации к D2O в качестве полноценных ростовых субстратов для выращивания штаммов хемогетеротрофных бактерий В. subtillis и В. amytoliquefaciens, а также штамма галобактерий Н. halobium ET1001.
Адаптация хемогетеротрофных бактерий B. subtittis и В. amyloliqucfaciens. В следующих опытах была исследована способность к росту на тяжёлой воде штаммов хемогетеротрофных бактерий В. subtillis (his, tyr, ade, иrа), и В. amyloliquefaciens (ade, иrа), продуцентов инозина и тимидина, соответственно. Мы предположили, что замедление роста бактерий на минимальных средах, содержащих тяжёлую воду могло быть обусловлено появлением ауксотрофности по отдельным ростовым факторам. Чтобы проверить это предположение, в дальнейшем мы использовали комплексные среды. Как и предполагалось, обе культуры удалось адаптировать к дейтерию путём рассева на твёрдые среды, приготовленные из 99,9 ат.% D2O. Они сразу обнаружили нормальный рост на тяжёлой воде. У штаммов В. subtilis и В. amyloliquefaciens при росте на D2O было отмечено сохранение высокого уровня продукции по инозину и тимидину (3,9 и 3,0 г/л соответственно).
Адаптация галобактерий Н. halobium ET 1001. В случае с Н. halobium ET 1001 адаптацию проводили как на агаре, содержащим 99,9 ат.% D2O путём рассева штамма до отдельных колоний, так и на жидкой среде с D2O. В обычных для этой бактерии условиях культивирования (37 oС, на свету) в клетках синтезировался фиолетовый пигмент по спектральным характеристикам не отличающийся от природного бактериородопсина.
2. Изучение роста и биосинтеза бас полученными штаммами
Изучение ростовых характеристик М. flagellatum на средах, содержащих CH3OH/CD3OD и D2O, а также 13СН3ОН. Данные по росту штамма М. flagellatum на минимальных средах М9 с добавкой 1 об.% СН3ОН и его меченных аналогов (СD3OD/13СН3ОН) и содержащих ступенчато увеличивающиеся концентрации тяжелой воды приведены в таблице 1.
Таблица 1.
Влияние изотопного состава среды М9 на рост штамма M. flagelaum*.
- Номер опыта; Компоненты среды, об.%; Величина лаг-периода, ч; Время генерации, ч; Выход биомассы. % от контроля
- Н2О; D2О; СН3ОН; СD3ОD
- 1; 99,0; 0; 1,0; 0; 0; 1,1; 100
- 2; 99,0; 0; 0,5; 0,5; 0,2; 0,8; 91,0
- 3; 99,0; 0; 0; 1,0; 0,8; 1,0; 81,0
- 4; 49,5; 49,5; 1,0; 0; 2,4; 1,4; 76,0
- 5; 49,5; 49,5; 0,5; 0,5; 5,7; 1,2; 75,0
- 6; 49,5; 49,5; 0; 1,0; 6,7; 1,3; 70,0
- 7; 24,5; 74,5; 1,0; 0; 5,6; 1,4; 29,0
- 8; 99,0; 0; 1,0 13СН3ОН; 0; 0,1; 1,0; 72,0
Примечание: *Данные опытов 1–7 приведены для M. flagellatum при выращивании на водных средах М9, содержащих 0,5–1% СН3ОН/СD3ОD и указанное количество (об.%) D2О. Данные опыта 7 приведены для адаптированной к максимальному содержанию дейтерия в среде бактерии M. flagellatum при выращивании в среде М9, содержащей 1% СD3ОD и 74,5% D2О. Данные опыта 8 приведены для при выращивании M. flagellatum в среде М9, содержащей 1% 13СН3ОН. В качестве контроля использовали опыт 1, где использовали протонированную среду М9 с обычной водой и метанолом.
Как видно из таблицы 1, на средах, содержащих тяжёлую воду и изотопные аналоги метанола – CD3OD и 13CH3OH, выходы микробной биомассы составили 81% и 72% соответственно, а на средах с 74,5 об.% D2O выход биомассы составил 29%, что в 3,4 раза ниже, чем в контрольных экспериментах, когда использовали обычную воду и СН3ОН (табл. 1, опыты 1, 3, 8). Как видно, способность к росту у М. flagellatum сохранялась лишь в среде, содержащей 74,5 об.% D2O. Выше этой концентрации наблюдалось ингибирование скорости микробного роста.
Как следует из литературных данных (Складнее Д. А, 1990), введение стабильного изотопа углерода 13С не приводит к летальным последствиям для клетки, что мы и наблюдали в случае с М. flagellatum. В целом, полученные для М. flagellatum данные могут свидетельствовать о том, что адаптация к тяжёлой воде определяется как видовой специфичностью метилотрофных бактерий, так и особенностями их метаболизма. Кроме этого, из таблицы 1 следует, что данный подход можно эффективно использовать для введения в молекулы синтезируемых БАС двойной изотопной метки (дейтерий и изотоп углерода 13C).
Изучение ростовых и биосинтетических характеристик B. methylicum на средах, содержащих CH3OH/CD3OD и D2O. Данные по росту исходного и адаптированного к тяжёлой воде штамма В. methylicum и максимальному уровню накопления L-фенилаланина в культуральной жидкости на минимальных средах М9 с добавкой 2 об.% СН3OН и его дейтерированного аналога CD3OD, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды, представлены в таблице 2.
Как видно из табл. 2, в отсутствии дейтерий-меченных субстратов продолжительность лаг-периода не превышала 24 ч (см. табл. 2, опыт 1). С увеличением концентрации тяжёлой воды в среде продолжительность лаг-периода увеличивалась до 64,4 ч на средах с 98 об.% D2О и 2 об.% CD3OD (табл. 2, опыт 10). Отмечено, что длительность времени клеточной генерации с увеличением степени изотопного насыщения среды дейтерием постепенно увеличивается, достигая 4,9 часов на максимально дейтерированной среде (табл. 2, опыт 10).
Таблица 2.
Влияние изотопного состава среды М9 на рост штамма В. mehylicum и уровень накопления L-Phe в культуральной жидкости*.
- Номер опыта; Компоненты среды, об.%; Величина лаг-периода, ч; Выход биомассы. % от контроля; Время генерации, ч; Выход L-Phe, % от контроля
- Н2О; D2О; СН3ОН; СD3ОD; ; ; ;
- 1; 98,0; 0; 2; 0; 24,0; 100; 2,2; 100
- 2; 98,0; 0; 0; 2; 30,3; 92,3; 2,4; 99,1
- 3; 73,5; 24,5; 2; 0; 32,1; 90,6; 2,4; 96,3
- 4; 73,5; 24,5; 0; 2; 34,7; 85,9; 2,4; 97,1
- 5; 49,0; 49,0; 2; 0; 40,5; 70,1; 3,0; 98,0
- 6; 49,0; 49,0; 0; 2; 44,2; 60,5; 3,2; 98,8
- 7; 24,5; 73,5; 2; 0; 45,8; 56,4; 3,5; 90,4
- 8; 24,5; 73,5; 0; 2; 49,0; 47,2; 3,8; 87,6
- 9; 0; 98,0; 2; 0; 60,5; 32,9; 4,4; 79,5
- 10; 0; 98,0; 0; 2; 64,4; 30,1; 4,9; 71,5
- 10’; 0; 98,0; 0; 2; 39,9; 87,2; 2,9; 95,0
Примечание: *Данные (1–10) приведены для В. methylicum, не адаптированного к средам с высоким содержанием дейтерия. Данные 10’ приведены для адаптированного В. methylicum.
CD3OD не вызывал существенного ингибирования роста и не оказывал влияния на выход микробной биомассы, в то время как на средах с 98 об.% D2О микробный рост подавлялся (табл. 2, опыты 2, 4, 6, 8, 10). Так, на среде, содержащей 98 об.% D2О и 2 об.% СD3ОD, выход микробной биомассы был снижен в 3,3 раза по сравнению с контролем. Важно то, что выход микробной биомассы и уровень накопления L-фенилаланина в культуральной жидкости при росте адаптированного к тяжёлой воде штамма В. methylicum в полностью дейтерированной среде изменяются по сравнению с контрольными условиями на 12,8% и 5% соответственно, при увеличении времени генерации до 2,8 ч, а продолжительности лаг-периода до 40 ч (табл. 2, опыт 10’).
Адаптированный штамм возвращался к нормальному росту при переносе в протонированную среду М9 после пролонгированного лаг-периода, что доказывает фенотипическую природу феномена адаптации, что наблюдалось для других адаптированных нами штаммов бактерий. Улучшенные ростовые характеристики адаптированного метилотрофа существенно упрощают схему получения дейтеро-биомассы, оптимальным условиям которой удовлетворяет максимально дейтерированная среда М9 с 98% D2О и 2% CD3OD (инкубационный период ~5–6 сут при 35 0С).
Исследование биосинтеза L-фенилаланина штаммом В. methylicum. Общей особенностью биосинтеза L-Phe в протонированных минимальных средах М9 было значительное увеличение его продукции на ранней фазе экспоненциального роста В. methylicum, когда выход микробной биомассы был незначителен (рис. 1).
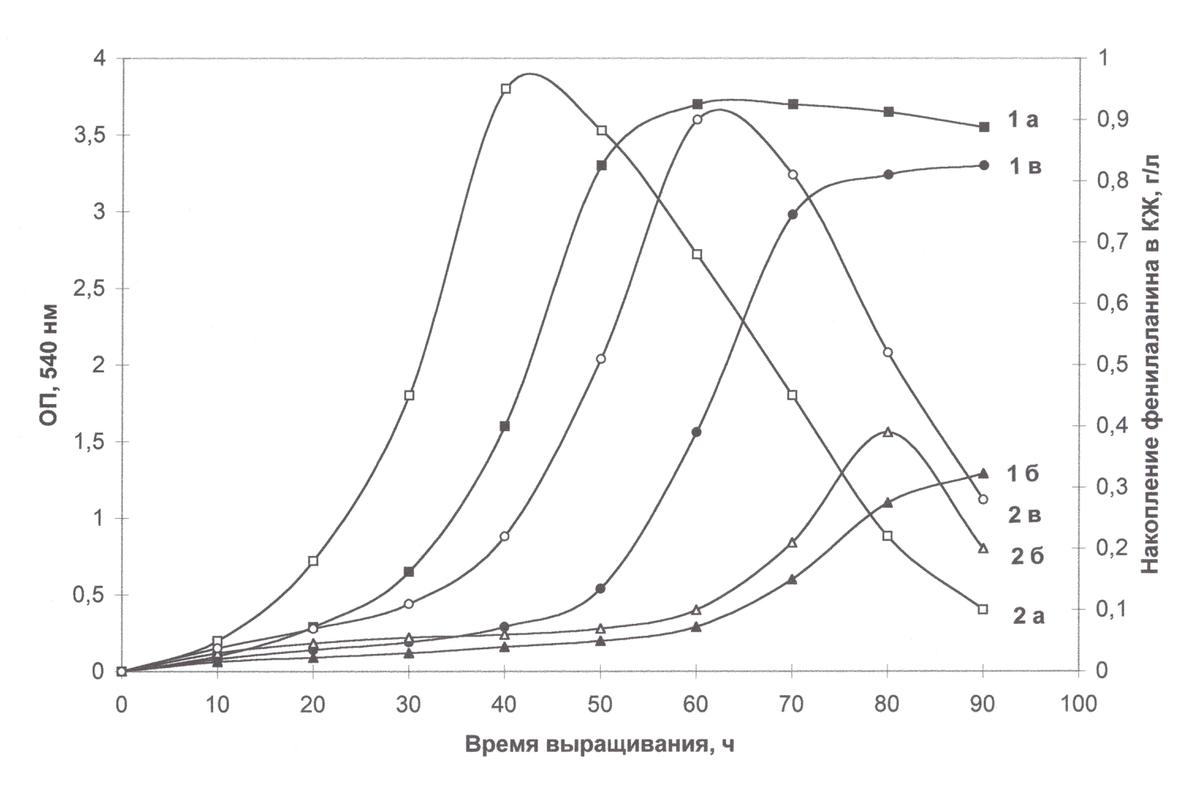
Рис. 1. Динамики роста В. methylicum (la, 1б, 1в) и накопления L-Phe в культуральной жидкости (2а, 2б, 2в) на средах с различным изотопным составом: а – исходный микроорганизм на протонированной среде М9; б – адаптированный микроорганизм на полностью дейтерированной среде; в – неадаптированный микроорганизм на полностью дейтерированной среде.
Во всех изотопных экспериментах наблюдалось ингибирование биосинтеза L-фенилаланина на поздней фазе экспоненциального роста и снижение его концентрации в ростовых средах. Согласно данным по микроскопическому исследованию растущей популяции микроорганизмов, наблюдаемый характер динамики секреции L-Phe не коррелировал с качественными изменениями ростовых характеристик культуры на различных стадиях роста, что служило подтверждением морфологической однородности микробной популяции. Скорее всего, накопленый в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Кроме того, мы не исключаем возможность, что при ферментации без рН-статирования может происходить обратное превращение экзогенного фенилаланина в интермедиаторные соединения его биосинтеза (фенилпируват), что отмечено в работах других авторов (Ворошилова Э.Б., Гусятипер М.М., 1989). За счёт использования данного штамма В. methylicum удалось получить около 1 г дейтерий-меченного L-Phe из 1 л среды. Данные по исследованию культуральной жидкости методом ТСХ показали, что кроме фенилаланина штамм B. methylicum синтезирует и накапливает в КЖ (на уровне 6–10 ммоль) метаболически связанные аминокислоты (аланин, валин, лейцин, изолейцин), присутствие которых подтверждалось масс-спектрометрическим анализом ЭУ производных аминокислот культуральной жидкости.
Изучение качественного и количественного состава внутриклеточных углеводов В. subtilis. В ходе выполнения работы был изучен качественный и количественный состав внутриклеточных углеводов при росте В. subtilis на среде с 99,9 ат.% D2О (табл. 3).
Таблица 3.
Качественный и количественный состав внутриклеточных углеводов В. subtilis при росте на 99,9% тяжёлой воде.
- Углевод; Содержание в биомассе, в % от сухого веса 1 г биомассы; Уровень дейтерированности, %
- Протонированный образец (контроль)*; Образец, полученный в D2O-среде
- Глюкоза; 20,01; 21,40; 80,6
- Фруктоза; 6,12; 6,82; 85,5
- Рамноза; 2,91; 3,47; 90,3
- Арабиноза; 3,26; 3,69; 90,7
- Мальтоза; 15,30; 11,62; -
- Сахароза; 8,62; не детектировалась; -
Примечание:* В качестве контроля использовали гидролизат биомассы B. subtilis, полученный в Н2О-среде. Прочерк означает отсутствие данных.
Фракция внутриклеточных углеводов в табл. 3 (нумерация приведена по последовательности их элюирования с колонки) представлена моно-сахаридами (глюкоза, фруктоза, рамноза, арабиноза), ди-сахаридами (мальтоза, сахароза), а также четырьмя другими неидентифицированными углеводами с временами удерживания 3,08 мин (15,63%), 4,26 мин (7,46%), 7,23 мин (11,72%) и 9,14 мин (7,95%) (не показаны). Выход глюкозы в дейтерированном образце составляет 21,4% от сух. веса, то есть выше, чем фруктозы (6,82%), рамнозы (3,47%), арабинозы (3,69%) и мальтозы (11,62%). Их выходы существенно не отличались от контроля на Н2О, за исключением сахарозы, которая в дейтерированном образце не детектируется (табл. 3). Уровни дейтерированности углеводов составили 90,7% D для арабинозы до 80,6% D для глюкозы.
Изучение аминокислотного состава биомассы метилотрофных бактерий В. methylicum. Аминокислотный состав гидролизата суммарных белков биомассы В. methylicum, полученного в ходе многоступенчатой адаптации к тяжёлой воде показан в таблице 4. Гидролизат биомассы В. methylicum представлен пятнадцатью идентифицированными аминокислотами (за исключением пролина, который детектировался при 440 нм). Результаты исследования показали небольшое снижение содержания в дейтерированном белке Ala, Leu и Нis по сравнению с белком, полученным на обычной воде, что может быть объяснено метаболическим воздействием тяжёлой воды на биосинтез аминокислот (табл. 4).
Таблица 4.
Качественный и количественный состав аминокислот гидролизата суммарных белков биомассы В. methylicum и уровни дейтерированности молекул*
- Аминокислота; Содержание в белке, % от сухого веса 1 г биомассы; Количество включенных атомов дейтерия в углеродный скелет молекулы; Уровень дейтерированности, %;
- Рост на 98% D2O; Рост на Н2О;
- Gly; 9,69; 8,03; 2; 90,0;
- Ala; 13,98; 12,95; 4; 97,5;
- Val; 3,74; 3,54; 4; 50,0;
- Leu; 7,33; 8,62; 5; 49,0;
- Ile; 3,64; 4,14; 5; 49,0;
- Phe; 3,94; 3,88; 8; 95,0;
- Tyr; 1,82; 1,56; 7; 92,8;
- Ser; 4,90; 11,68; 3; 86,6;
- Thr; 5,51; 4,81; -; -;
- Met; 2,25; 4,94; -; -;
- Asp; 9,59; 7,88; 2; 66,6;
- Glu; 10,38; 11,68; 4; 70,0;
- Lys; 3,98; 632; 5; 58,9;
- Arg; 5,27; 4,67; -; -;
- His; 3,72; 3,43; -; -;
Примечание:* Данные получены для метиловых эфиров N-(диметиламино)нафтален-1-сульфонил хлоридных (дансильных) производных аминокислот. При подсчёте уровня дейтерированности протоны (дейтероны) при СООН- и NH2-группах молекул аминокислот не учитывались из-за лёгкости изотопного (Н-D) обмена. Прочерк означает отсутствие данных.
Изучение ростовых и биосинтетических характеристик В. subtilis на средах, содержащих тяжёлую воду и гидролизаты дейтеро-биомассы метилотрофных бактерий. Графики, отражающие динамику роста, ассимиляции глюкозы и накопление инозина в культуральной жидкости штаммом В. subtilis в условиях протонированной среды и среды, с 99,9 ат.% D2O представлены на рис. 2. Как видно из рис. 2, при переносе клеток со стандартной на дейтерированную среду выход микробной биомассы, продолжительность лаг-периода и длительность времени клеточной генерации в целом изменяются незначительно. При росте исходного штамма В. subtilis на среде, содержащей обычную воду уровень накопления инозина в культуральной жидкости достигал величины 17,3 г/л после пяти суток культивирования (рис. 2).
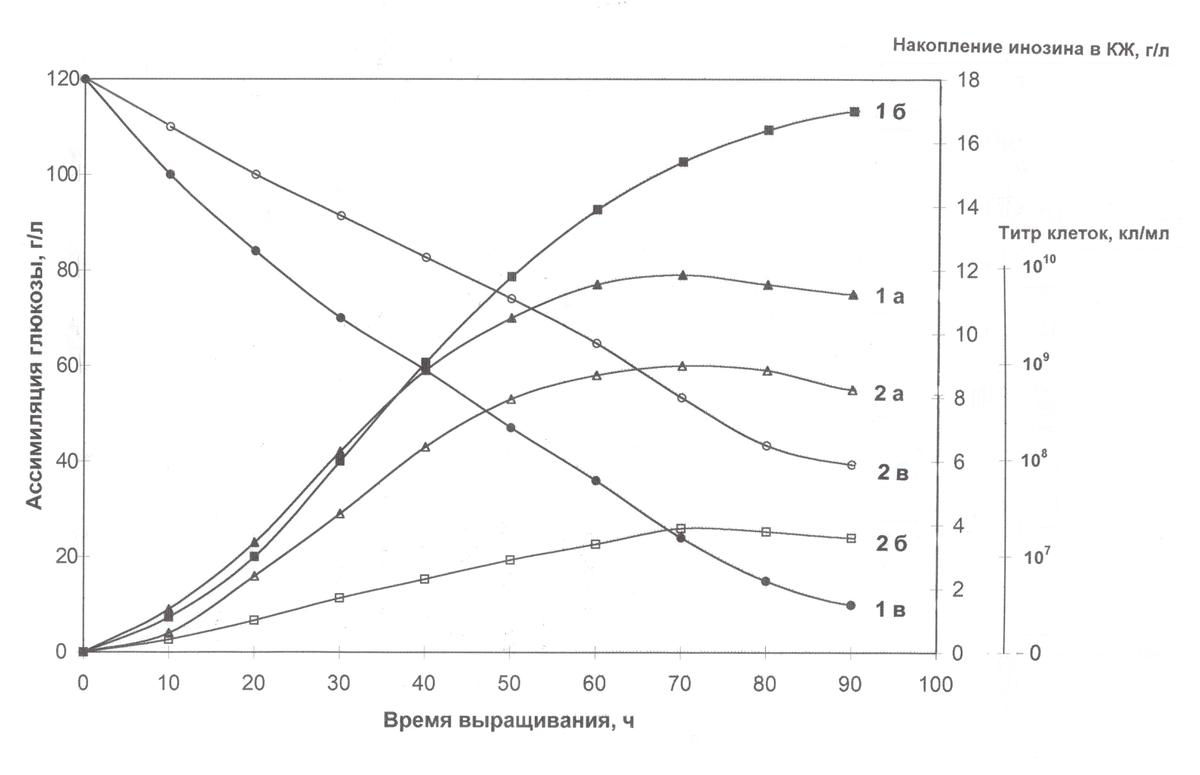
Рис. 2. Динамики роста B. subtilis (1a, 2a), конверсии глюкозы (1б, 2б) и накопления инозина в культуральной жидкости (1в, 2в) на средах с различным изотопным составом: 1 а, б, в – микроорганизм на обычной протонированной БВК-среде; 2 а, б, в – микроорганизм на максимально дейтерированной среде с 2 %-ным гидролизатом дейтеро-биомассы метилотрофных бактерий B. methylicum.
Отмечена корреляция в характере изменения ростовых динамик (рис. 2, 1а, 2а), выхода инозина (рис. 2, 1б, 2б) и ассимиляции глюкозы (рис. 2, 1в, 2в). При выращивании адаптированного B. subtilis в максимально дейтерированной среде, уровень накопления инозина в культуральной жидкости снижается по-сравнению с исходным штаммом в протонированной среде. Максимальный выход инозина (17 г/л) зафиксирован в опыте 1б (рис. 2, 1б) на протонированной среде при уровне ассимилируемой глюкозы 10 г/л (рис. 2, 1в). На тяжеловодородной среде выход инозина снижался в 4,4 раза (3,9 г/л) (рис. 2, 2б), а уровень ассимиляции глюкозы в 4 раза, о чем свидетельствует 40 г/л остаточной неассимилируемой глюкозы в культуральной жидкости (рис. 2, 2в). Сниженный выход инозина в максимально дейтерированной среде находится в корелляции с уровнем конверсии глюкозы, которая в D2O ассимилировалась не полностью, что свидетельствует, что при росте в D2О глюкоза расходуется менее эффективно, чем в контрольных условиях.
Полученные для исследуемых микроорганизмов данные, в целом, подтверждают устойчивое представление о том, что адаптация клетки к тяжёлой воде является фенотипическим явлением, поскольку адаптированные к тяжёлой воде клетки возвращаются к нормальному росту и биосинтезу в протонированных средах после некоторого лаг-периода. В то же время обратимость роста на D2O/H2O-cpeдax теоретически не исключает возможности того, что этот признак стабильно сохраняется при росте в тяжёлой воде, но маскируется при переносе клеток на протонированную среду. Можно предположить, что клетка реализует лабильные адаптивные механизмы, которые способствуют функциональной реорганизации работы ферментных систем в тяжёлой воде. Также не исключено, что наблюдаемые при адаптации эффекты связаны с образованием в тяжёлой воде более прочных и стабильных связей, чем связей с участием водорода. По теории абсолютных скоростей разрыв С-H-связей может происходить быстрее, чем C-D-связей, подвижность D3О+ меньше, чем подвижность Н3О+, константа ионизации D2O в 5 раз меньше константы ионизации Н2О (Crespy J., Kalz H.H., 1979). Эти эффекты не могут не отразиться на кинетике химической связи и скорости химических реакций в D2O. При попадании клетки в тяжёловодородную среду из неё не только удаляется протонированная вода за счет реакции обмена Н2О–D2О, но и происходит быстрый H–D обмен в гидроксильных (-ОН), сульфгидрильных (-SH) и аминогруппах (-NH2) всех органических соединений, включая белки, нуклеиновые кислоты, жирные кислоты, углеводы. Известно, что в этих условиях только ковалентная С–Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С–D могут синтезироваться de novo (Crespi, 1986). С точки зрения физиологии, наиболее чувствительными к замене протия на дейтерий могут оказаться аппарат биосинтеза макромолекул и дыхательная цепь, т. е. именно те клеточные системы, которые используют высокую подвижность протонов и высокую скорость разрыва водородных связей.
3. Изучение степеней включения изотопов дейтерия и углерода 13С в молекулы экзогенных аминокислот
B. METHYLICUM и М. FLAGELLATUM.
Получение лиофилизованных образцов культуральных жидкостей, содержащих экзогенные дейтерий- и 13С-аминокислоты. Дейтерий-меченные аминокислоты были выделены в составе препаратов лиофилизованных интактных культуральных жидкостей, свободных от белков и полисахаридов, при росте штамма В. methylicum на минимальных средах с добавкой 2 об% СНзОН и с различным содержанием тяжёлой воды. 13С-аминокислоты были получены за счет культивирования штамма М. flagellatum на среде, содержащей обычную воду и 1 об% 13СНзОН. Данные по степеням включения дейтерия и 13С в молекулы экзогенных аминокислот двух исследуемых штаммов приведены в таблице 5. Во всех анализируемых образцах культуральной жидкости независимо от рода штаммов методом масс-спектрометрии ЭУ были обнаружены аланин, валин, лейцин/изолейцин и фенилаланин (табл. 5). В масс-спектрах ЭУ дериватизованной культуральной жидкости M. flagellatum в дополнение к вышеобозначенным аминокислотам также фиксировался глицин.
Получение метиловых эфиров N-дансил- и карбобензокси-производных аминокислот. Степени включения изотопов дейтерия и изотопа углерода 13С в мультикомпонептные смеси аминокислот в составе культуральной жидкости и белковых гидролизатов определяли методом масс-спектромстрии ЭУ метиловых эфиров Dns-аминокислот или в виде Cbz-производных аминокислот после их препаративного разделения методом ОФ ВЭЖХ.
Аналитическое и препаративное разделение Cbz-производных аминокислот проводили ОФ ВЭЖХ, разработанным Егоровой Т. А. (Егорова Т. А., 1993). Степени хроматографической чистоты выделенных из культуральных жидкостей В. methylicum и М. flagellatum Dns-производных дейтерий- и 13С-аминокислот составили 93-95%, а выходы 65-87% соответственно.
Предложенная нами модификация метода синтеза производных аминокислот заключалась в прямой химической обработке препаратов культуральной жидкости, полученной после отделения клеток, DnsCl (и CbzCl) и CN2H2. Реакцию проводили в щелочной среде в присутствии 4 н. NaOH в водно-органическом растворителе (ацетон) в соотношении DnsCl/CbzCl-аминокислота, равным 5:1 (см. схему ниже).
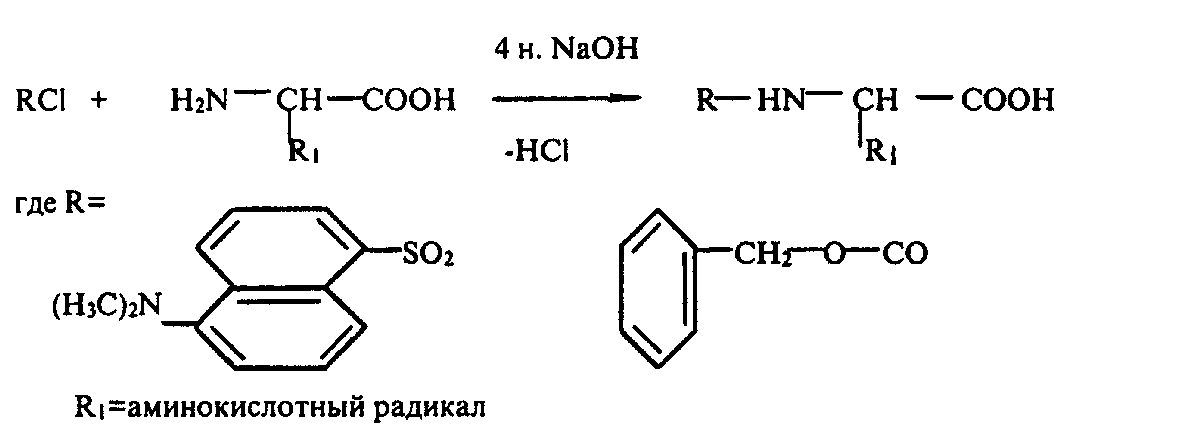
Схема. Реакция синтеза DNs- и Cbz-производных аминокислот.
Для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с моно-производными было характерно образование ди-Z-(Dns)-производных: ди-Cbz-(Dns)-лизина, ди-Cbz-(Dns)-гистидина, О,N-ди-Cbz-(Dns)-тирозина, О,N-ди-Cbz-(Dns)-серииа, O,N-Cbz-(Dns)-тpeoнина и N,S-ди-Cbz-(Dns)-цистеина. Кроме этого, из аргинина синтезировался три-Cbz-(Dns)-аргинин.
Летучесть Dns- и Cbz-производных аминокислот при масс-спектрометрическом анализе повышали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана в качестве этерифицирующего реагента был связан с необходимостью проведения реакции в мягких условиях, исключающих обратный изотопный (H-D)-обмен в ароматических аминокислотах. При использовании диазометана происходило дополнительное N-метилирование по a-NH2 гpynne аминокислот, в результате чего в масс-спектрах метиловых производных аминокислот фиксировались дополнительные пики, соответствующие соединениям с молекулярной массой на 14 масс. ед. больше исходных.
Исследование степеней включения дейтерия в молекулу L-фенилаланина В. methylicum, полученного со сред с тяжёлой водой. Как видно из данных табл. 2, рост данного штамма метилотрофных бактерий на средах с возрастающими концентрациями тяжёлой воды сопровождался снижением уровней накопления клеточной биомассы, увеличением времени генерации бактерий и продолжительности лаг-периода при сохранении способности синтезировать и накапливать L-Phe в ростовой среде. Поэтому было интересно изучить, как изменяются степени включения дейтерия в молекулу L-Phe и других аминокислот В. methylicum в этих условиях.
Во всех опытах наблюдалось специфичное возрастание уровней изотопного включения дейтерия в молекулы аминокислот при ступенчатом увеличении концентраций тяжёлой воды в ростовой среде (табл. 5). Так, для индивидуальных аминокислот культуральной жидкости В. melhylicum, количество включённых атомов дейтерия по скелету молекул варьирует в пределах 49%-ной концентрации D2O и составляет для Phe – 27,5%, Ala – 37,5%, Val – 46,3%, Leu/Ile – 47% (табл. 5). Аналогичное увеличение молекулярной массы аминокислот в зависимости от концентрации тяжёлой воды в среде было зафиксировано во всех изотопных экспериментах.
Таблица 5.
Степени включения (ат.%) дейтерия и изотопа углерода 13С в молекулы секретируемых аминокислот В. melhylicum и M. flagellation*.
- Аминокислоты; Содержание D2О в среде, %; 13СН3ОН
- 24,5; 49,0; 73,5; 98,0; 1
- Gly; -; -; -; -; 60,0
- Ala; 24,0; 37,5; 62,5; 77,5; 35,0
- Val; 20,0; 46,3; 43,8; 58,8; 50,0
- Leu/Ile; 15,0; 47,0; 46,0; 51,0; 38,0
- Phe; 15,0; 27,5; 51,3; 75,0; 95,0
Примечание: * Данные по включению дейтерия в аминокислоты приведены для В. methyticum при росте на средах, содержащих 2 об.% СН3ОН и 24,5; 49,5; 73,5; 98,0 об.% D2O. Данные по включению 13С приведены для М. flagellatum при росте на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О.
Исследование степеней включения дейтерия в сопутствующие аминокислоты В. methylicum на средах с тяжёлой водой. В масс-спектрах ЭУ всех исследуемых образцов культуральной жидкости B. melhylicum кроме основной секретируемой аминокислоты (фенилаланин) были обнаружены примеси, метаболически с ней связанных аланина, валина и лейцина/изолейцина (на уровне 3–5 мМ). В опыте, где концентрация тяжёлой воды в среде составила 49 об.% (таблица 5, опыт 5), изотопный состав фенилаланина характеризовался увеличением молекулярной массы на 4,1 единицу, аланина на 2,5 единицы, валина – 3,5 единицы, а лейцина/изолейцина – на 4,6 единиц. Таким образом, в отличие от фенилаланина, количество включенного дейтерия в последних трех аминокислотах сохраняет стабильное постоянство в довольно широком интервале концентраций тяжёлой воды (от 49 об.% до 98 об.%).
В связи с тем, что штамм – продуцент фенилаланина В. methylicum был ауксотрофом по лейцину, эту аминокислоту в немеченном виде добавляли в ростовую среду, содержащую 98 об.% D2О. Как показали наши исследования по включению дейтерия в молекулы экзогенных аминокислот, в условиях ауксотрофности по лейцину степень изотопного обогащения лейцина, а также метаболически связанных с ним аминокислот немного ниже, чем для других аминокислот. Так, при росте В. methylicum на среде, содержащей 98 об.% D2O и немеченный L-Leu, степени включения дейтерия в молекулу Leu составили 51,0%, Ala –77,5%, Val – 58,8% (табл. 5). Суммируя полученные данные, можно сделать вывод о сохранении минорных путей метаболизма, связанных с биосинтезом лейцина de novo. Другим объяснением наблюдаемого эффекта может быть ассимиляция клеткой не меченного лейцина из среды на фоне биосинтеза меченного изолейцина de novo.
Исследование степеней включения дейтерия в L-Phe В. methylicum в максимально дейтерированной среде. Мы предположили, что за счёт ауксотрофности штамма В. methylicum по лейцину, уровни включения дейтерия в секретируемыи фенилаланин на фоне максимальных концентраций тяжёлой воды могут быть ниже теоретически допустимых вследствие функционирования в клетке ряда биохимических реакций, связанных с ассимиляцией протонированного лейцина извне. Как и ожидалось, отмеченная особенность лучше всего проявлялась при биосинтезе фенилаланина на дейтерированной среде, в которой единственным протонированным соединением, кроме метанола, являлся лейцин (см. табл. 5, опыт 9). В этом опыте степень дейтерированности фенилаланина составила 75%, т.е. только шесть атомов (из восьми в углеродном скелете) в молекуле фенилаланина биосинтетически замещены на дейтерий. Согласно данным масс-спектрометрического анализа, атомы дейтерия распределены по положениям С1–С6ароматической части фенилаланина и сопредельному положению b, причем, как миниум четыре из них могут быть локализованы в самом в бензильном С6Н5СН2-фрагменте молекулы фенилаланина. Из масс-спектрометрических данных следует, что при других концентрациях D2О дейтерий также включается в ароматическое кольцо фенилаланина, так как метаболизм адаптированного к D2О штамма B. methylicum не претерпевает существенных изменений в D2О. Результат по получению фенилаланина с данным характером включения метки важен для биотехнологического использования и имеет существенные преимущества по сравнению с химическим (Н–D)-обменом (Griffiths D. V., 1986).
Исследование степени включения дейтерия в молекулу фенилаланина за счёт конверсии дейтерометанола CD3OD в В. methylicum. Контроль за включением дейтерия в молекулу L-Phe за счет конверсии CD3OD при росте бактерий на среде, содержащей обычную воду и 2 об.% CD3OD (соответствуют опыту 2, табл. 1) показал незначительное количество дейтерия, которое поступает в молекулу L-фенилаланина вместе с углеродом CD3OD; уровень дейтерированнности молекулы фенилаланина был вычислен по величине пика с m/z 413 за вычетом вклада пика примеси природного изотопа (не более 4%). Полученный результат может быть объяснён разбавлением дейтериевой метки за счёт протекания как биохимических процессов, связанных с распадом CD3OD при его ассимиляции клеткой, так и реакциями изотопного обмена и диссоциации в тяжёлой воде. Так, из четырёх атомов дейтерия, имеющихся в молекуле СD3OD, лишь один атом дейтерия при гидроксидной группе самый подвижный и поэтому легко диссоциирует в водной среде с образованием СD3ОН. Три оставшихся атома дейтерия в составе СD3ОН входят в цикл ферментативного окисления метанола, который, в свою очередь, мог привести к потере дейтериевой метки за счёт образования соединений более окисленных, чем метанол. В частности, такое включение дейтерия в молекулу L-фенилаланина подтверждает классическую схему ферментативного окисления метанола до формальдегида в клетках метилотрофов, который лишь после этого ассимилируется у данного штамма метилотрофных бактерий РМФ-путем фиксации углерода (Nesvera J., 1991).
Исследование степеней включения изотопа углерода 13С в молекулы экзогенных аминокислот М. flagellatum за счёт биоконверсии 13СН3ОН. Наши исследования подтвердили, что для получения 13С-аминокислот за счет микробной конверсии 13СН3ОН предварительная адаптация не является лимитирующим этапом, поскольку этот субстрат не оказывает негативного биостатического эффекта на ростовые и биосинтетические характеристики метилотрофов. При росте М. flagellatum на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О клетка продуцирует лейцин, a также глицин, аланин, валин и фенилаланин. Как видно из таблицы 5, уровни изотопного включения 13С в молекулы Gly, Ala, Val и Phe составляют 60%, 35%, 50% и 95% ат. дейтерия соответственно. При этом низкая степень включения изотопа углерода 13С в метаболически связанные с изолейцином аминокислоты обусловлена эффектом ауксотрофиости бактерий в изолейцине, который добавляли в ростовую среду в немеченном виде.
4. Изучение степеней включения изотопов дейтерия и углерода 13С в аминокислотные остатки суммарных белков
B. METHYLICUM и М. FLAGELLATUM.
Выделение дейтерий- и 13С-аминокислот из белковых гидролизатов. Поскольку при работе с микробной биомассой возникают проблемы, связанные с очисткой от сопутствующих компонентов, было необходимо применять специальные подходы при выделении фракции суммарных белков из бактериальных источников.
При выделении фракции суммарных белков биомассы метилотрофных бактерий (В. methylicum, M. flagellatum) учитывалось наличие в них углеводов. Мы использовали богатые по белку штаммы бактерий со сравнительно небольшим содержанием углеводов в них, гидролизу в качестве фракции суммарных белков подвергали остаток после исчерпывающего отделения пигментов и липидов экстракцией органическими растворителями (метанол–хлороформ–ацетон).
Во всех случаях гидролиз белков проводили в 6 н. растворе DCl (3% фенола в D2O) или в 4 н. растворе Ва(ОН)2 для предотвращения реакций обратного изотопного обмена (H–D) в ароматических аминокислотах и их разрушения.
Дейтерий- и 13С-меченные аминокислоты в составе гидролизатов суммарного белка биомассы были разделены методом ОФ ВЭЖХ со степенью хроматографической чистоты 93–96% и выходами 75–89% в условиях, аналогичных таковым для разделения секретируемых аминокислот (табл. 6). Эти данные подтверждены данными по разделению белковых гидролизатов метилотрофных бактерий методом ионнообменной хроматографии на колонке Biotronic LC 5001.
Исследование степеней включения дейтерия в аминокислотные остатки суммарных белков биомассы В. methylicum на средах с тяжёлой водой. Общие принципы изучения степени изотопного обогащения молекул аминокислот при данном способе введения метки продемонстрированы на примере анализа включения дейтерия в мультикомпонентные смеси аминокислот, полученные после гидролиза суммарных белков биомассы в 6 н. DCl и 4 н. Ва(ОН)2.
Таблица 6.
Степени включения (ат.%) дейтерия и изотопа углерода 13С в аминокислотные остатки общих белков биомассы В. melhyiicum и М. flagellatum.
- Аминокислоты; Содержание D2O в среде, об.%; 13СН3ОН
- 24,5; 49,5; 73,5; 98,0; 1
- Gly; 15,0; 35,0; 50,0; 90,0; 90,0
- Ala; 20,0; 45,0; 62,5; 97,5; 95,0
- Val; 15,0; 36,3; 50,0; 50,0; 50,0
- Leu/Ile; 10,0; 42,0; 45,0; 49,0; 49,0
- Phe; 24,5; 37,5; 50,0; 95,0; 80,5
- Туr; 20,0; 48,8; 68,8; 92,8; 53,5
- Ser; 15,0; 36,7; 47,6; 86,6; 73,3
- Asp; 20,0; 36,7; 60,0; 66,6; 33,3
- Glu; 20,0; 40,0; 53,4; 70,0; 40,0
- Lys; 10,0; 21,1; 40,0; 58,9; 54,4
Примечание: *Данные по включению дейтерия в аминокислоты приведены для В. methylicum при росте на средах, содержащих 2 об.% СН3ОН и 24,5; 49,5; 73,5; 98,0 об.% D2O. Данные по включению 13С приведены для М. flagellatum при росте на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О.
Во всех экспериментах по изучению содержания дейтерия в аминокислотных остатках белка наблюдалась корреляция между степенью изотопного насыщения среды и уровнями включения дейтерия в аминокислоты (табл. 6), Например, для индивидуальных аминокислот белковых гидролизатов количество включенных атомов дейтерия по скелету молекулы варьирует незначительно в пределах 49%-ной D2O и составляет для Ala - 45%, Val – 36,3%, Leu/Ile – 42%, Phe – 37,5%.
Исследование степеней включения дейтерия в аминокислотные остатки суммарных белков В. melhylicum на максимально дейтерированной среде. Полученные данные свидетельствуют о возможности достижения максимальных уровней включения дейтерия в аминокислотные остатки белков за счет адаптации культуры В. melhyiicum к росту и биосинтезу на среде М9 с максимальной концентрацией тяжёлой воды. Как видно из таблицы 6, при росте В. methylicum на среде, содержащей 98 об.% D2O, степени включения дейтерия в остатки Gly, Ala и Phe составляют 90%, 97,5% и 95% ат. дейтерия, т.е. уровень мечения можно считать униформным. Низкие степени включения дейтерия в молекулы лейцина (49%), а также в метаболически связанных аминокислотах в этих условиях могут быть объяснены за счет ауксотрофности штамма в лейцине, который добавляли в среду культивирования в протонированной форме. Полученный результат по разбавлению дейтериевой метки в лейцине может быть объяснён сохранением доли минорных реакций в биосинтезе лейцина de novo.
Исследование степеней включения изотопа углерода 13C в аминокислотные остатки суммарных белков М. flagellatum за счёт биоконверсии 13СH3ОН. В экспериментах по включению изотопа углерода 13С в молекулы суммарных белков за счёт биоконверсии 13СH3ОН метилотрофными бактериями М. flagellalum была показана эффективность мечения аминокислот изотопом углерода 13С. Так, в молекуле Phe детектировалось 80,5% дейтериевой метки, в Ala – 95%, в Gly – 90% (см. табл. 6).
Во всех экспериментах степени включения дейтерия и изотопа углерода 13С в молекулы метаболически связанных аминокислотах обнаружили определённую коррелляцию. Так, степени изотопного обогащения аланина, валина и лейцина (семейство пирувата), фенилаланина и тирозина (семейство ароматических аминокислот, синтезируемых из шикимовой кислоты) совпадают (табл. 6). Степени изотопного включения глицина и серина (семейство серина), аспарагиновой кислоты и лизина (семейство аспарагина) также имеют близкие величины. Сравнивая данные таблицы 5 и 6, можно заключить, что степени изотопного обогащения экзогенных аминокислот и соответствующих аминокислотных остатков суммарного белка, в целом, также коррелируют.
Как и в случае с экзогенными аминокислотами, низкие степени включения изотопа углерода 13С в остатки Leu при росте на 1 об.% 13СНзОН обусловлены ауксотрофностью бактерий в этой аминокислоте.
Таким образом, нам удалось достичь максимальных уровней включения стабильных изотопов в суммарные белки биомассы метилотрофных бактерий. Поэтому мы посчитали возможным использовать гидролизаты их дейтеро-биомассы для биосинтеза других изотопно-меченных БАС в последующих экспериментах.
5. Исследование возможности использования гидролизатов биомассы метилотрофных бактерий В. METHYLICUM в качестве субстратов для получения [1',3',4',2,8-D5]-инозина.
Получение [1',3',4',2,8-D5]-инозина. В следующих экспериментах было апробировано использование дейтеро-биомассы факультативных метилотрофных бактерий B. methylicum, полученных на предыдущем этапе работы в условиях многоступенчатой адаптации к тяжёлой воде для синтеза высокодейтерированных нуклеозидов (на примере инозина).
Для биосинтеза дейтерий-меченого инозина использовали штамм грамположительных бактерий B. subtilis (предварительно адаптированный к дейтерию скринингом до отдельных колоний), который из-за нарушения метаболических путей регуляции биосинтеза пуриновых рибонуклеозидов синтезирует в стандартных условиях выращивания (БВК-среда, поздний экспоненциальный рост, 32-34 0С) 17 г инозина на 1 л культуральной жидкости. Максимальный выход инозина достигался при использовании природной протонированной среды, содержащей в качестве источников ростовых факторов и аминного азота 2% БВК дрожжей, а в качестве источника углерода и энергии глюкозу (не менее 12 мас.%).
Выделение инозина заключалось в низкотемпературном осаждении высокомолекулярных примесей органическими растворителями ацетоном и метанолом при -4 0С, адсорбции/десорбции на поверхности активированного угля, экстрактивного извлечения рибонуклеозидов этанольно-аммиачным раствором при 60 0С, а инозина – экстракцией 0,3 М NH4-формиатным буфером (рН 8,9), с последующей перекристаллизацией в 80% этаноле и ионообменной хроматографии на катионообменнике AG50WX 4, уравновешенным 0,3 М NH4-формиатным буфером с 0,045 М NH4Cl с ТСХ контролем при Rf = 0,5. Степень хроматографической чистоты инозина составила 92%.
Достоинства разработанного метода получения дейтерий-меченного инозина заключаются в следующих аспектах:
- в способности высокоактивного штамма В. subtilis к росту и биосинтезу инозина на средах, содержащих максимальные концентрации тяжёлой воды;
- замене глюкозы и аминокислот, необходимых для роста этого штамма-ауксотрофа на гидролизаты дейтеро-биомассы В. methylicum. При последующих ферментациях в качестве источника ростовых факторов можно использовать ту же дсйтеро-биомассу метилотрофных бактерий, либо биомассу самого штамма-продуцента, содержащую в своем составе соединения, которые могут служить источниками углерода и ростовых факторов;
- в практически полном отсутствии отходов: согласно схеме, дейтеро-биомасса базового штамма, после гидролиза в 6 н. DCl возвращается в цикл в качестве ростовых факторов;
- в высокой степени изотопного обогащения дейтерий-меченного инозина (62,5% атомов водорода в молекуле замещены на дейтерий);
- в высоких выходах (3,9 г/л) дейтерий-меченного инозина.
Исследование уровня дейтерированности инозина. Уровень дейтерированности инозина исследовали методом масс-спектрометрии FAB из-за высокой чувствительности, позволяющей детектировать 10-8–10-10 моль вещества в пробе. При анализе степени дейтерированности инозина учитывались следующие аспекты. Во-первых, вследствие того, что протоны в C1–C'5 положениях рибозной части молекулы инозина могли происходить из глюкозы, мы предположили,что характер биосинтетического включения дейтерия в рибозную часть молекулы инозина определяется, в основном, функционированием ряда процессов гексозо-6-моно-фосфатного (ГМФ) шунта, связанных непосредственно с ассимиляцией глюкозы и других сахаров. Во-вторых, многочисленные обменные процессы и внутримолекулярные перегруппировки, происходящие с участием тяжёлой воды, могли также привести к специфическому включению метки по определенным позициям в молекуле инозина. Такими доступными позициями в молекуле инозина признаны, прежде всего, гидроксильные протоны и протоны при гетероатомах -NH (последние могут обмениваться на дейтерий в тяжёлой воде за счет кето-енольной таутомерии). Три атома дейтерия в рибозном остатке молекулы инозина могли происходить за счет функционирования многочисленных реакций ГМФ-шунта, два атома дейтерия а остатке гипоксантина также могли синтезироваться de novo.
6. Разработка способов биосинтетического получения дейтерий-меченhoго бактериородопсина
Получение дейтерий-меченного бактериородопсина. В качестве другой модельной системы для введения стабильной изотопной метки в белки, использовали ретинальсодержащий белок бактериородопсин (БР), выполняющий роль АТФ-зависимой транслоказы в клеточной мембране солелюбивой галобактерии H. halobium ET 1001. БР – фотопреобразующий белок с молекулярным весом 26,7 кДа представляет собой хромопротеид, связанный альдиминной связью с остатком лизина-216, который содержит в качестве хромоформной группы эквимолекулярную смесь 13-цис- и полностью 13-транс-ретиналя, определяющего пурпурно-красный цвет галобактерий. Полипептидная цепь БР состоит из 248 аминокислотных остатков, 67% которых являются гидрофобными и ароматическими, а 33% – гидрофильными остатками из аспарагиновой и глутаминовой кислотами, аргинином и лизином. Эти остатки играют важную структурно-функциональную роль в пространственной ориентации α-спиральных участков молекулы БР. Молекулы БР организованы в клеточной мембране в виде тримеров; каждый тример окружен шестью другими так, что образуется правильная гексагональная решетка. Молекула БР состоит из семи находящихся в конформации α-спирали сегментов, пронизывающих всю толщу мембраны клетки в направлении, перпендикулярном ее плоскости (рис. 3). Гидрофобные домены представляют собой трансмембранные сегменты, а гидрофильные домены выступают из мембраны и соединяют отдельные внутримембранные α-спиральные участки белковой молекулы БР.
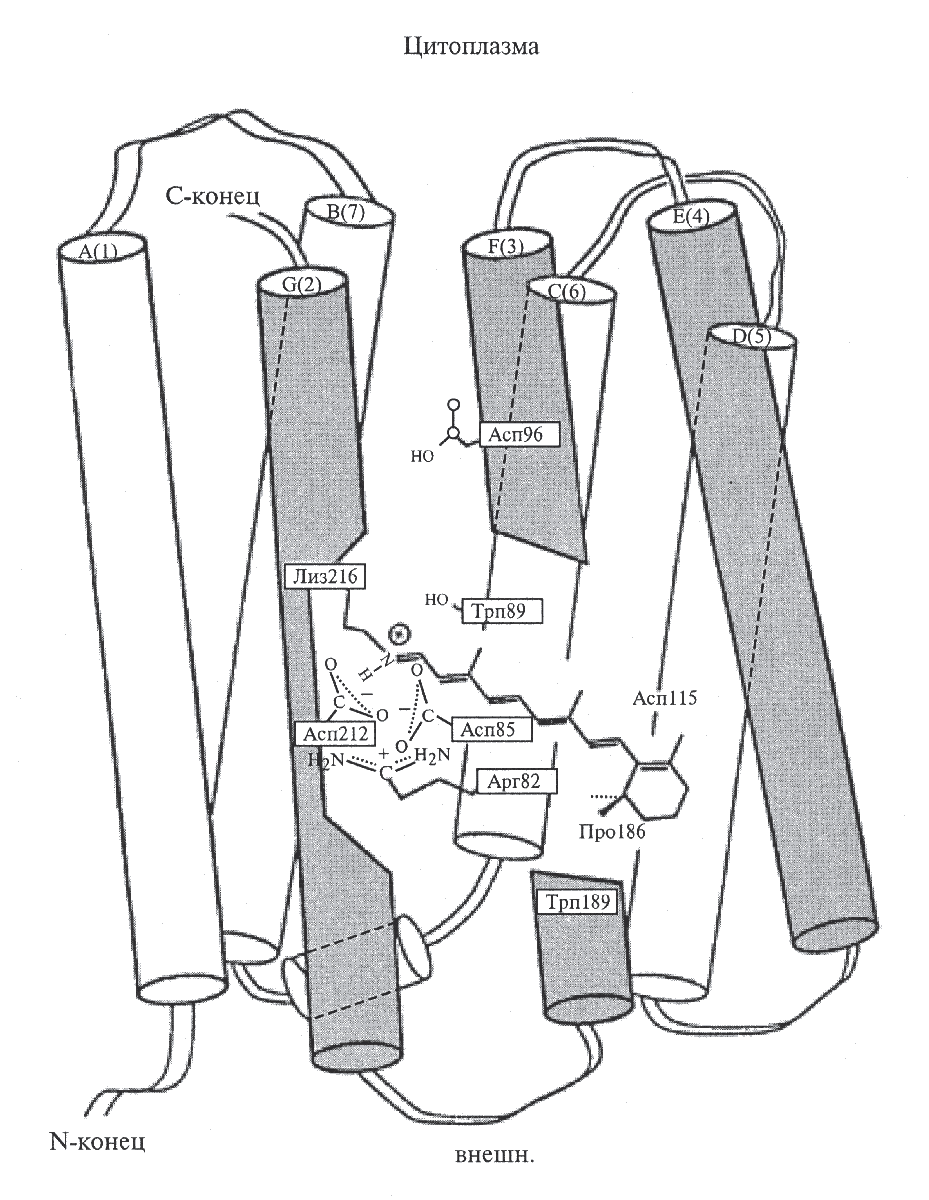
Рис. 3. Расположение белковой части молекулы БР и остатка ретиналя в клеточной мембране галобактерии H. halobium по данным компьютерного моделирования: белковые фрагменты молекулы БР в виде 7 пронизывающих клеточную мембрану a-спиральных сегментов обозначены латинскими буквами; темным цветом обозначены сегменты, ответственные за связывание остатка ретиналя в молекуле БР с белковой частью молекулы.
Выбор способа выделения БР был определен целью исследования, связанной с изучением принципиальной возможности получения дейтерий-меченных препаратов БР в препаративных количествах. Для включения дейтериевой метки в молекулу БР использовали два принципиально отличных подхода: сайт-специфическое введение отдельных аминокислот: L-[2,3,4,5,6-D5]-Phe, L-[3,5-D2]-Tyr и L-[2,4,5,6,7-D5]-Trp в БР и униформное мечение БР дейтерием путем выращивания H. halobium ET 1001 на среде, содержащей 99,9 ат.% D2O и 2% гидролизат дейтеро-биомассы В. methylicum. При выборе L-[2,3,4,5,6-D5]-фенилаланина, L-[3,5-D2]-тирозина и L-[2,4,5,6,7-D5]-триптофана в качестве источников изотопных меток, учитывалась важность этих аминокислот в функционировании БР, стабильность дейтерий-меченных аналогов этих аминокислот к (H–D) обмену в водной среде в условиях культивирования, а также возможность их детектирования методами масс-спектрометрии.
Основными этапами получения дейтерированных препаратов БР являлись: выращивание галобактерий H. halobium на синтетических средах тяжелой водой и [2, 3, 4, 5, 6-D5]-фенилаланином (0,26 г/л), [3, 5-D2]-тирозином (0,2 г/л) и [2, 4, 5, 6, 7-D5]-триптофаном (0,5 г/л), выделение фракции пурпурных мембран (ПМ), отделение от низко- и высокомолекулярных примесей, клеточной РНК, каротиноидов и липидов, промывка 50% этанолом при –4 0С, фракционирование солюбилизированного в 0,5% ДДС-Na белка метанолом, гель-проникающая хроматография на сефадексе G-200, электрофорез в 12,5% ПААГ с 0,1% ДДС-Na.
В оптимальных условиях выращивания галобактерий H. halobium, в клетке синтезировался каротиноидсодержащий фиолетовый пигмент, по спектральному соотношению белкового и хромофорного фрагментов молекулы D280/D568= 1,5 : 1 полностью идентичный природному БР (рис. 4). Как показали результаты исследования, рост галобактерий на комплексной синтетической среде (рис. 7, б) ингибировался незначительно по сравнению с контролем (рис. 4, а) на пептоновой среде, что существенно упрощает и удешевляет оптимизацию условий биосинтеза БР, который заключается в культивировании галобактерий в синтетической среде TS при освещении монохромным светом с λ = 560 нм в течение 4–5 сут при 35 0С.
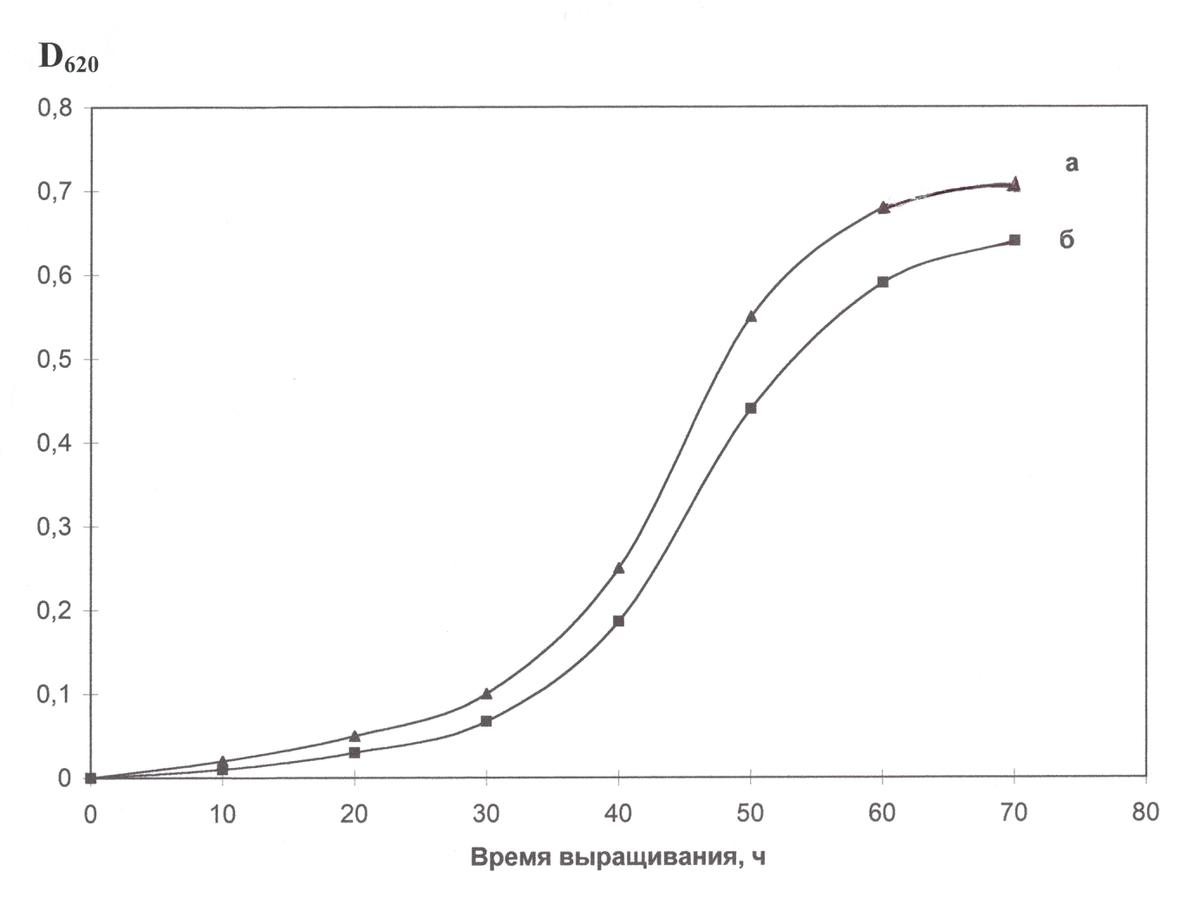
Рис. 4. Динамика роста галобактерии H. halobium в различных экспериментальных условиях: пептоновая среда (а), комплексная синтетическая среда (б). Условия выращивания: период инкубации 4–5 сут при 35 0С, освещение монохромным светом с длиной волны λ = 560 нм.
Выделяемый белок локализуется в ПМ; разрушение мембран и освобождение от низкомолекулярных примесей и внутриклеточного содержимого достигали осмотическим шоком клеток дист. водой на холоде после удаления 4,3 М NaCl и последующим разрушением клеточной оболочки ультразвуком при 22 кГц. Затем проводили обработку клеточного гомогената РНК-азой I (2–3 ед. акт.).
Оба подхода показали хорошие результаты по введению дейтериевой метки в молекулу БР. Так, в масс-спектре ЭУ гидролизата БР, полученного с селективной среды, содержащей L-[2,3,4,5,6-D5]-Phe, L-[3,5-D2]-Tyr и L-[2,4,5,6,7-D5]-Trp, после обработки реакционной смеси Dns-Cl и CN2Н2фиксируются пики, соответствующие молекулярным ионам обогащённых дейтерием Dns-Phe-OMe с М+ при m/z 417 (вместо m/z 412 в контроле), Dns-Tyr-OMe с М+ при m/z 429 (вместо m/z 428) и Dns-Trp-OMe с М+ при m/z 456 (вместо m/z 451). В случае с униформным мечением БР, метка включалась равномерно по всем положениям углеродного скелета в аминокислотных остатках белка. ОФ ВЭЖХ метиловых эфиров Dns-, и Cbz- аминокислот, полученных после гидролиза БР в 4 н. Ва(ОН)2 или 6 н. DCl (3 масс.% фенола, в D2O) показала высокие степени хроматографической чистоты выделенных производных аминокислот. Согласно данным, степени хроматографической чистоты выделенных дейтерий-меченных L-[2,3,4,5,6-D5]-Phe, L-[3,5-D2]-Tyr и L-[2,4,5,6,7-D5]-Trp составили 96%, 97% и 98% соответственно.
Выводы:
- Подобраны условия для проведения адаптации штаммов B. melhylicum, H. halobium, В. subiilis и B. amyloliquefaciens к росту на D2О-средах. Селекционно отобраны колонии клеток, сохранившие высокие ростовые и биосинтетические характеристики на средах с максимальными концентрациями тяжёлой воды.
- Показана принципиальная возможность использования суммы химических компонентов дейтеро-биомассы факультативных метилотрофных бактерий В. methylicum в качестве источников ростовых субстратов для синтеза высокодейтерированных БАС.
- Изучено влияние меченных субстратов – D2O, CD3OD и 13СН3ОН на ростовые и биосинтетические параметры различных штаммов-продуцентов аминокислот, белков и нуклеозидов. Показано, что униформные уровни включения дейтерия в молекулы синтезируемых БАС можно получить, используя высокодейтерированные среды (D2О и СD3D), а в случае с 13С-мечением того же результата можно достигнуть за счёт использования 13СНзОН.
- Предложена дансильная модификация образцов культуральной жидкости для изучения степеней изотопного обогащения аминокислот методом масс-спектрометрии электронного удара. Метод позволяет проводить анализ изотопного состава мультикомпонентных смесей аминокислот, как свободных аминокислот из культуральной жидкости, так и аминокислот в составе гидролизатов суммарных белков биомассы.
- Проведено сравнительное изучение степеней включения дейтерия и изотопа углерода 13С в молекулы секретируемых аминокислот, так и в аминокислотные остатки суммарных белков биомассы метилотрофных бактерий в условиях их роста на средах, содержащих ступенчато увеличивающие концентрации тяжёлой воды.
- Определена корреляция между уровнем включения изотопной метки в молекулы аминокислот и концентрации тяжёлой воды в ростовых средах.
- Разработана схема получения дейтерий-меченных БАС с высокими степенями изотопного обогащения, основанная на использовании етеротрофных микроорганизмов - продуцентов соответствующих БАС. Данная схема проверена на примере получения дейтерий-меченных инозина и бактериородопсина.
- Исследованы методы селективного и униформного введения дейтериевой метки в бактериородопсин. Показано, что включение отдельных дейтерий-меченных аминокислот в молекулу бактериородопсина носит селективный характер, а использование адаптированного к D2O Н. halobium ET 1001 на средах с меченными субстратами и 99,9% D2O позволяет получать униформно меченный бактериородопсин.
Список публикаций по теме диссертационной работы.
- Мосин О. В., Карнаухова Е. Н., Пшеничникова А. Б., Складнев Д. А., Акимова О. Л. Биосинтетическое получение дсйтерий-мсченного L-фенилалаиина, секрстируемого метилотрофным мутантом Brevibaclerium methylicum // Биотехнология. 1993. №9. С. 16-20,
- Егорова Т. А., Мосин О. В., Еремин С. В., Карнаухова Е. Н., Звонкова Е. Н., Швец В. И. Препаративное разделение аминокислот белковых гидролизатов в виде бензилоксикарбонильных производных // Биотехнология. 1993. № 8. С. 21-25.
- Беккер Г. Д., Мосин О. В., Карнаухова Е. Н. Аминокислоты, меченные стабильными изотопами: получение и масс-спектро метрически и контроль. (Тезисы докл. 4-й Всероссийской научной конференции "Проблемы теоретической и экспериментальной химии")- Екатеринбург. 20-22 апрель 1994. С. 127-128.
- Мосин О. В., Карнаухова Е. Н., Складнев Д. А., Акимова О. Л., Цыганков Д, Ю. Штамм Brevibacterium methylicum - продуцент униформно меченной дейтерием аминокислоты L-фенилаланина. Заявка РФ № 93055824 от 15.12.1993.
- Казаринова Л. А., Королькова Н. В., Миронов А. С., Мосин О. В.. Складнев Д. А., Юркевич А. М. Способ получения высокодейтерированных нуклеозидов и нуклеотидов. Заявка РФ № 95118778 от 14.11.1995.
- Karnaukhova Е. N., Mosin О. V., Reshetova О. S. Biosynthetic production of stable isotope labeled ammo acids using methylotroph Methylobacillus flagellatum // Ammo Acids. 1993. V. 5. № 1. P. 125.
- Mogin O. V., Karnaukhova E. N., Pshenichnikova А. В., Reshetova O. S. Electron impact spectrometry in bioanalysis of stable isotope labeled bacteriorhodopsin. 6th International Conference on Retinal Proteins. 19-24 June 1994. Leiden. The Netherlands. P. 115.
- Mosin O. V,. Karnaukhova E. N., Skladnev D. A. Application of methylotrophic bacteria for preparation of stable isotope labeled amino acids. 7thInternational Symposium on the Genetics of Industrial Microorganisms. 26 June 1994. Quebec. Canada. P. 163.
- Matveev A. V., Mosin_O.V., Skladnev D. A., Yurkevich A. M., and Shvcts V. Melhylolrophic adaptation to highly deuterated substrates. 8th International Symposium on Microbial Growth on Ci-Compounds. 27 August-l September 1995. San Diego. U.S.A. P. 49.
- Mosin O. V., Karnaukhova E. N., Skladnev D. A., and Shvets V. I. Preparation of D-and 13C-amino acids via bioconvertion of Ci-substrates, 8lh International Symposium on Microbial Growth on Сi-Compounds. 27 August-l September 1995. San Diego. U.S.A. P. 80.
- Shvets V. I., Yurkevich A. M., Mosin_O. V., Skladnev D. A. Preparation of deuterated inosine suitable for biornedical application // Karadeniz Journal of Medical Sciences. 1995. V. 8. № 4. P. 231-232.
- Мосин О. В., Складнее Д. А., Егорова Т. А., Юркевич А. М., Швец В. И. Исследование биосинтеза аминокислот штаммом Brevibacterium methylicum на средах, содержащих тяжелую воду. II Биотехнология. № 3. 1996. С. 3-12.
- Мосин О. В., Егорова Т. А., Чеботаев Д. В., Складнев Д. А., Юркевич А. М., Швец В. И. Получение бантериородопсина, меченного по остаткам ароматических аминокислот L-фенилаланина, L-тирозина и L-триптофана // Биотехнология. № 4. 1996. С. 27-35.
- Мосин _О.В., Казаринова Л. А., Преображенская Е. С., Складнев Д. А., Юркевич А. М., Швец В. И. Рост бактерии Bacillus subtilis и биосинтез инозина на высокодейтерированной среде. // Биотехнология. № 4. 1996. С. 19-27.