Выделение изотопномеченых аминокислот из белковых гидролизатов микроорганизмов
Биомасса микроорганизмов, выращенных на средах, содержащих стабильные изотопы, является ценным источником различных изотопномеченых БАС, в том числе аминокислот. При этом наиболее распространённым и традиционным методом препаративного выделения аминокислот из клеточной биомассы является её гидролиз с использованием ферментативных или химических методов и последующая ионообменная хроматография на катионои анионообменных смолах (дауэкс, амберлит, пермутит, аминекс, дуолит и др.) [133]. Большое значение при проведении гидролиза белка имеет выбор того или иного гидролизирующего агента, который определяется целью исследования.
Ферментативное расщепление протеолитическими ферментами может протекать ступенчато с концов молекулы (экзопептидазами) или путём расщепления специфических отдельных пептидных связей полипептидной цепи (эндопептидазами), причём специфичность зависит от конфигурации, аминокислотной последовательности и конформации белка [134]. Для селективного химического расщепления белков разработано очень много методов [135], среди которых имеется несколько методов расщепления по -углеродному атому (например, через остатки дегидроаланина). Щёлочи и кислоты обладают высокой гидролизующей способностью и поэтому их использование приводит к разрушению некоторых аминокислот и к изотопному обмену в триптофане, тирозине и гистидине и в некоторых других аминокислотах.
В условиях щелочного гидролиза (4 н. Ba(OH)2 или NaOH, 24 ч, 1100) реакций изотопного обмена водорода на дейтерий практически не наблюдается (исключением является протон (дейтерон) у атома С2’ гистидина) [136].
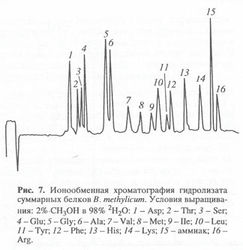
Существенным недостатком щелочного гидролиза, лимитирующим его использование, является значительная рацемизация аминокислот. Поэтому для препаративных целей щелочной гидролиз используется крайне редко, в то время как кислотный - очень широко. Кислотный гидролиз в стандартных условиях (6 н. НCl или 8 н. Н2SO4, 24 ч, 1100), как известно, приводит к полному разрушению триптофана и частичному разрушению серина, треонина и некоторых других аминокислот [137]. Добавление в реакционную среду фенола [138], тиогликолевой кислоты [139], -меркаптоэтанола [140], позволяет сохранить до 80-85% триптофана. Кроме этого, в условиях кислотного гидролиза с высокой скоростью протекает изотопный обмен ароматических протонов (дейтеронов) в молекулах триптофана, тирозина и гистидина [141], а также протонов (дейтеронов) при атоме С3 аспарагиновой и С4 глутаминовой кислот [142]. Поэтому для получения реальных данных о биосинтетическом включении дейтерия в белок рекомендуется проводить кислотный гидролиз в присутствии дейтерированных реагентов. Этим способом могут быть выделены и анализированы с использованием ионообменной хроматографии большинство аминокислот в составе гидролизатов белка (рис. 3). Так, при помощи ионообменной хроматографии были препаративно выделены [2H], [13C]и [15N]аминокислоты из белковых гидролизатов разных природных источников с выходами индивидуальных аминокислот от 77% до 95% и с уровнями изотопного включения, превышающими 95% [143]. Однако, метод выделения аминокислот из гидролизатов биомассы, будучи широко применяем на практике часто требует использования вредных буферных растворов (ацетат, формиат, пиридин и др.), нескольких колонок с последующей рехроматографией для полного выделения чистых аминокислот из гидролизатов биомассы.
[13C]аминокислоты были выделены из гидролизатов суммарных белков биомассы штамма метаногенных бактерий Methanobacterium espanolae при росте бактерий на [1-13C]и [2-13C]ацетате с уровнями включения 13С в молекулы аминокислот до 90% [145]. Согласно цитируемым там данным, менее 2% случайной метки в молекулах аминокислот были распределены между атомами углерода в позициях, происходящих из 13С карбоксильной или метильной группы ацетата и еще меньший процент включения метки детектировался в положениях углеродного скелета молекул, образованных из 13СО2.
Большой практический интерес представляет реализация преимуществ препаративной обращенно-фазовой высокоэфективной жидкостной хроматографии (ОФ ВЭЖХ) при получении оптически чистых меченых аминокислот и их N-производных в количествах, необходимых для биоаналитических и синтетических целей [146, 147]. Так, в работе [147] описан метод препаративного выделения индивидуальных аминокислот из различных микробиологических источников с помощью ОФ ВЭЖХ в виде бензилоксикарбонильных производных (N-Cbz производных) аминокислот. Разработанный метод позволяет выделять аминокислоты с высоким выходом (от 67% до 89%) и хроматографической чистотой (96-99%) [147] и может быть использован для выделения [2H]-, [13C]-, [15N] и [18O]аминокислот из белковых гидролизатов различных источников.