О.В. Мосин, к.х.н.
Обзор методов опреснения морской воды
Глобальной проблемой человечества в новом тысячелетии становится проблема получения пригодной для питья пресной воды. Дефицит пресной воды остро ощущается на территории более 40 стран, расположенных в засушливых областях земного шара и составляющих около 60% всей поверхности суши. Мировое потребление воды в начале XXI века достигло 120-150·109 м3 в год. Растущий мировой дефицит пресной воды может быть скомпенсирован опреснением солёных (солесодержание более 10 г/л) и солоноватых (2-10 г/л) океанических, морских и подземных вод, запасы которых составляют 98% всей воды на земном шаре.
Пресная вода является ценной составной частью морской воды. Нехватка пресной воды все больше ощущается в индустриально развитых странах, как США и Япония, где потребность в пресной воде для бытовых нужд, сельского хозяйства и промышленности превышает имеющиеся запасы. В таких странах, как Израиль или Кувейт, где уровень осадков очень низок, запасы пресной воды не соответствуют потребностям в ней, которые возрастают в связи с модернизацией хозяйства и приростом населения. В дальнейшем человечество окажется перед необходимостью рассматривать океаны как альтернативный источник воды.
Россия по ресурсам поверхностных пресных вод занимает первое место в мире. Однако до 80% этих ресурсов приходится на районы Сибири, Севера и Дальнего Востока. Всего около 20% пресноводных источников расположено в центральных и южных областях с самой высокой плотностью населения и высокоразвитыми промышленностью и сельским хозяйством. Некоторые районы Средней Азии (Туркмения, Казахстан), Кавказа, Донбасса, юго-восточной части РФ, обладая крупнейшими минерально-сырьевыми ресурсами, не имеют источников пресной воды. Вместе с тем ряд районов нашей страны располагает большими запасами подземных вод с общей минерализацией от 1 до 35 г/л, не используемых для нужд водоснабжения из-за высокого содержания растворенных в воде солей. Эти воды могут стать источниками водоснабжения только при условии их дальнейшего опреснения.
Важным параметром морской воды при опреснении является солёность, под которой подразумевается масса (в граммах) сухих солей (преимущественно NaCl) в 1 кг морской воды. Средняя солёность вод мирового океана постоянна и составляет 35 г/кг морской воды.
Наряду с NaCl в морской воде содержатся K+, Mg2+, Ca2+, Sr2+, Br-, F-, H3BO3, которые можно получать из морской воды в промышленных масштабах (Таблица). Среди других веществ, содержащихся в морской воде в концентрациях от 1 млн. д. до 0,01 млн. д., встречаются литий (Li), рубидий (Rb), фосфор (P), йод (J), железо (Fe), цинк (Zn) и молибден (Mo). Кроме этих элементов в морской воде обнаружено около 30 других элементов в более низких концентрациях.
Таблица
Химические вещества, содержащиеся в морской воде
в концентрации выше 0,001 г/кг (1 млн.д.) по весу
Химическое вещество
Содержание, г/кг морской воды
Концентрация, моль/л морской воды
Хлориды Сl-
19,35
0,55
Натрий Na+
10,76
0,47
Сульфаты SО42-
2,71
0,028
Магний Mg2+
1,29
0,054
Кальций Са2+
0,412
0,010
Калий К+
0,40
0,010
Диоксид углерода СО2
0,106
2,3 . 10-3
Бромиды Вr-
0,067
8,3 . 10-4
Борная кислота Н3ВО3
0,027
4,3 . 10 -4
Стронций Sr2+
0,0079
9,1 . 10-5
Фториды F-
0,001
7 . 10-5
Высокая концентрация солей делает морскую воду непригодной для питьевых и хозяйственных целей. Поэтому её необходимо опреснять, т.е. проводить обработку с целью снижения концентрации растворённых солей до 1 г/л. Опреснение воды может осуществляться химическими (химическое осаждение, ионный обмен), физическими (дистилляция, обратный осмос или гиперфильтрация, электродиализ, вымораживание) и биологическими методами с использованием способности некоторых фотосинтезирующих водорослей избирательно поглощать NaCl из морской воды.
За последние годы были также предложены новые альтернативные методы опреснения морской воды за счёт воздействия ультразвуком, акустическими, ударными волнами, электромагнитными полями и др.
Многообразие существующих методов получения пресной воды объясняется тем, что ни один из них не может считаться универсальным, приемлемым для данных конкретных условий. Характеристики методов опреснения, получивших наибольшее практическое применение приводятся ниже.
Химическое опреснение
При химическом способе опреснения в морскую воду вводят специальные осаждающие реагенты, которые при взаимодействии с растворёнными в ней ионами солей (хлориды, сульфаты), образуют нерастворимые, выпадающие в осадок соединения. Вследствие того, что морская вода содержит большое количество растворенных веществ, расход реагентов весьма значителен и составляет примерно 3—5% количества опресненной воды. К веществам, способным образовывать нерастворимые соединения с ионами натрия (Na+) и хлора (Cl-), относятся соли серебра (Ag+) и бария (Ba2+), которые при обработке солёной воды образуют выпадающие в осадок хлористое серебро (AgCl) и сернокислый барий (BaSO4). Эти реагенты дорогостоящие, реакция осаждения с солями бария протекает медленно, соли бария токсичны. Поэтому химическое осаждение при опреснении воды используется очень редко.
Дистилляция
Дисцилляция воды (перегонка) основана на различии в составе воды и образующегося из нее пара. Процесс осуществляется в специальных дистилляционных установках – опреснителях путем частичного испарения воды и последующей конденсации пара. В процессе дистилляции более летучий компонент (низкокипящий) переходит в паровую фазу в большем количестве, чем менее летучий (высококипящий). Поэтому при конденсации образовавшихся паров в дистиллят переходят низкокипящие, а в кубовый остаток — высококипящие компоненты. Если из исходной смеси отгоняется не одна фракция, а несколько, дистилляция называется фракционной (дробной). В зависимости от условий процесса различают простую и молекулярную дистилляцию.
Дистилляционная опреснительная установка состоит из испарителя 1, снабженного теплообменным устройством для подвода к воде необходимого количества теплоты; нагревательного элемента 2 для частичной конденсации пара, выходящего из испарителя (при фракционной дистилляции); конденсатора 3 для конденсации отбираемого пара; насоса 4; сборников дистиллята 5 и кубового остатка 6 (рис. 1).
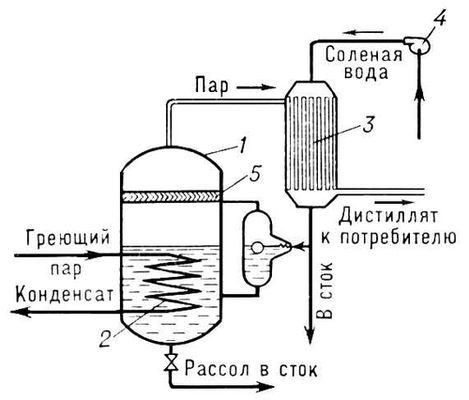
Рис. 1. Схема одноступенчатого дистилляционного опреснителя: 1 — корпус испарительной камеры; 2 — нагревательный элемент; 3 — конденсатор; 4 — насос; 5 — сборник дистиллята.
Современные дистилляционные опреснители подразделяются на одноступенчатые, многоступенчатые с трубчатыми нагревательными элементами, или испарителями, многоступенчатые с мгновенным вскипанием и парокомпрессионные.
Многоступенчатый испаритель (рис. 2) состоит из ряда последовательно работающих испарительных камер с трубчатыми нагревательными элементами. Нагреваемая солёная вода движется внутри трубок нагревательного элемента, греющий пар конденсируется на внешней поверхности. При этом нагрев и испарение воды в первой ступени осуществляются паром рабочего котла, работающего на дистилляте; греющим паром следующей ступеней служит вторичный пар предыдущей испарительной камеры. Данная установка способна вырабатывать около 0.9 т. пресной воды на 1 т. первичного пара. Расход тепла на получение 1 кг пресной воды в одноступенчатом дистилляционном опреснителе составляет около 2400 кдж.
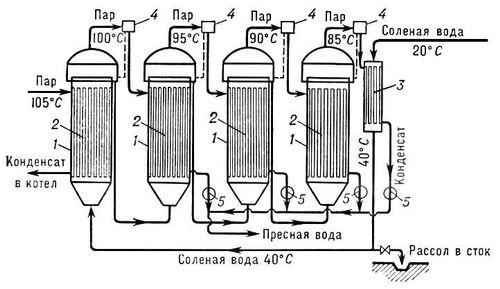
Рис. 2. Схема многоступенчатого дистилляционного опреснителя с трубчатыми нагревательными элементами: 1 — испарительные камеры 1, 2, 3 и 4-й ступеней; 2 — трубчатые нагревательные элементы; 3 — концевой конденсатор; 4 — брызгоулавливатель; 5 — насос.
В опреснителях с мгновенным вскипанием (рис. 3) солёная вода проходит последовательно через конденсаторы, встроенные в испарительные камеры, нагреваясь за счёт тепла конденсации, затем поступает в главный подогреватель и нагревается выше температуры кипения воды в первой испарительной камере, где происходит процесс кипения. Затем пар конденсируется на поверхности трубок конденсатора, а конденсат стекает в конденсатор и насосом откачивается потребителю. Неиспарившаяся вода перетекает через гидрозатвор в следующую камеру с более низким давлением, где она снова вскипает, и т.д. Рекуперация тепла фазового перехода в многоступенчатом опреснителе позволяет снизить расход тепла по сравнению с одноступенчатым дистилляционным опреснителем на 1 кг пресной воды до 250—300 кдж.
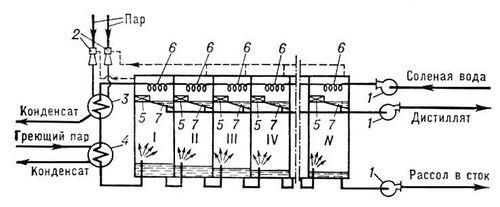
Рис. 3. Схема многоступенчатого дистилляционного опреснителя с мгновенным вскипанием: I, II, III, IV и N — камеры испарения; 1 — насос; 2 — паровой эжектор; 3 — конденсатор эжектора; 4 — подогреватель; 5 — брызгоулавливатель; 6 — конденсатор; 7 — поддон для сбора конденсата.
Основным преимуществом многоступенчатых дистилляционных опреснительных установок является то, что на единицу первичного пара можно получить значительно большее количество обессоленной воды. Так при одноступенчатом испарении на 1 т первичного пара получают около 0.9 т опресненной воды, а на установках, имеющих 50-60 ступеней – 15-20 т опресненной воды. Удельный расход электроэнергии в дистилляционных установках составляет 3,5-4,5 кВт час/м3 дистиллята.
Затраты при осуществлении любого варианта процесса дистилляции связана с большими затратами тепловой энергии, составляющими 40% от стоимости получаемой воды (если проводить дистилляцию в вакууме, температура кипения воды понижается до 60 0С и дистилляция требует меньших тепловых затрат). В качестве источников тепловой энергии используются атомные и тепловые электростанции. Сочетание дистилляционной установки с тепловой электростанцией на минеральном или ядерном топливе, так называемая многоцелевая энергетическая установка, позволяет обеспечить промышленный район всеми видами энергетических услуг по минимальной себестоимости при наиболее рациональном использовании топлива. В пустынных южных районах и на безводных островах применяются солнечные опреснители; которые производят в летние месяцы около 4 л воды в сутки с 1 м2 поверхности, воспринимающей солнечную радиацию.
Эффективность работы дистилляционных испарителей ограничена образованием накипи в системе циркуляции горячего рассола. По мере выпаривания морской воды из дистилляционого опреснителя, раствор соли становится более концентрированным, и в конечном итоге осаждается на стенках аппарата в виде накипи из солей жёсткости, состоящих, главным образом, из хлоридов и карбонатов кальция (CaCO3,CaCl2) и магния (MgCO3, MgCl2 ), что ухудшает теплопроводность стенок теплообменника, приводит к разрушению труб и теплообменного оборудования. Это требует применения специальных антинакипных добавок, что существенно увеличивает энергозатраты на проведение дистилляции до 10 кВт час/м3 обессоленной воды. Поэтому в последние годы предложены другие способы опреснения морской воды, которые не связаны с необходимостью ее испарения и конденсации.
Ионный обмен
Метод основан на свойстве твёрдых полимерных смол разной степени сшивки, ковалентно связанных с ионогенными группами (иониты), обратимо обмениваться ионами растворённых в воде солей (проивоионы).
В зависимости от заряда иониты подразделяются на положительно заряженные катиониты (H+) и отрицательно заряженные аниониты (OH-). В катионитах – веществах, аналогичным кислотам, анионы представлены в виде нерастворимых в воде полимеров, а катионы (Na+) подвижны и обмениваются с катионами растворов. В противоположность катионитам, аниониты - по химической структуре основания, нерастворимую структуру которых образуют катионы. Их анионы (обычно гидроксильная группа ОН-) способны обмениваться с анионами растворов.
Процесс ионнообменного опреснения воды заключается в последовательном прохождении воды через через неподвижный слой ионита в периодическом процессе или противоточным движением воды и ионита в непрерывном процессе (рис. 4). В этом процессе катионы и анионы солей обрабатываемой воды последовательно связываются с ионитами, в результате происходит её обессоливание. Соотношение ионита, анионита и катионита обычно составляет от 1:1 до 1.5:1.0 по массе.
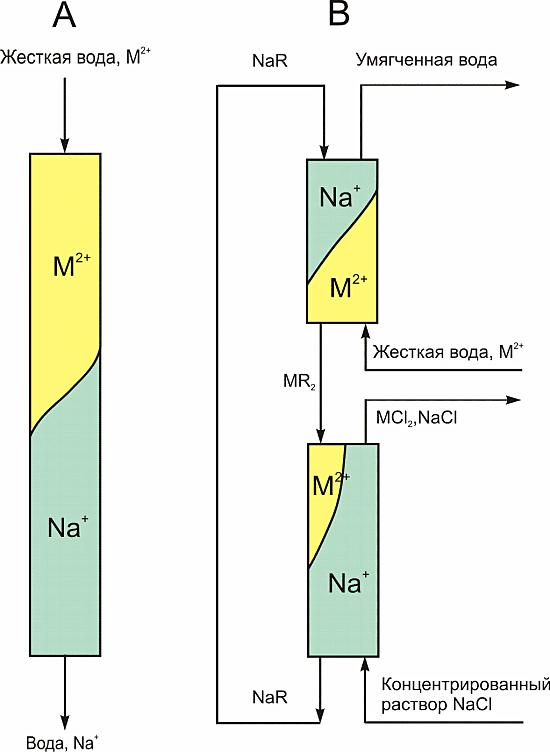
Рис. 4. Схемы ионообменного опреснения воды (М2+ = Са2+, Mg2+) на неподвижном слое ионита (а) и в противотоке (б) с движущимися слоями ионита (NaR, MR2) и потоками воды.
Кинетика ионного обмена включает 3 последовательные стадии: перемещение сорбируемого иона к поверхности глобулы ионита (1), ионный обмен (2), перемещение вытесняемого иона внутри глобулы ионита и от его поверхности в растворе (3).
На скорость ионного обмена влияют следующие факторы: доступность фиксированных ионов внутри каркаса ионита, размер гранул ионита, температура, концентрация раствора. Общая скорость процесса ионного обмена определяется совокупностью процессов, происходящих в растворе (диффузия противоионов к грануле и от гранулы ионита) и в ионите (диффузия противоионов от поверхности к центру гранулы ионита и в обратном направлении; обмен противоионов ионита на противоионы из раствора). В условиях, приближенных к реальным условиям очистки воды, лимитирующим фактором, определяющим скорость ионного обмена, является диффузия ионов внутри гранулы ионита.
Обменная способность ионообменных смол постепенно снижается, и, в конечном итоге, исчерпывается. В этом случае требуется регенерация раствором кислоты (катионит) или щелочи (анионит), что восстанавливает исходные химические свойства смол. Катионит регенерируется 5%-м раствором серной кислоты, которую пропускают последовательно через катионит до появления кислой реакции. Удельный расход серной кислоты 55—60 г/г-экв. сорбированных катионов. Анионит регенерируется раствором 5%-ной кальцинированной соды или едкого натра с удельным расходом 70-75 г на 1 г-экв. задержанных анионов.
Ионный обмен применяется для получения обессоленной и умягчённой воды в тепловой и атомной энергетике и в промышленности; в цветной металлургии - при комплексной гидрометаллургической переработке руд, в пищевой промышленности, в медицинской промышленности при получении антибиотиков и и других лекарственных средств, а также для очистки сточных вод в целях организации оборотного водоснабжения. В настоящее время также разрабатываются ионообменные методы комплексного извлечения из океанской воды ценных минералов.
Промышленные аппараты для реализации ионного обмена подразделяются на 3 группы: установки типа смесителей-отстойников, установки с неподвижным и подвижным слоями ионита. Аппараты первого типа чаще всего используют в гидрометаллургии. В аппаратах с неподвижным слоем ионита исходные и обессоленыые растворы подаются в одном направлении (поточные схемы) или в противоположных (противоточные схемы). Такие аппараты используются для ионообменной очистки растворов, при умягчении и обессоливании морской воды. В непрерывно действующих противоточных аппаратах подвижный ионит перемещается сверху вниз под действием силы тяжести. Конструктивно противоточные аппараты подразделяются на 3 группы: со взвешенным или кипящим слоем ионита, с непрерывным движущимся слоем ионита и с двищущимся раствором через ионит.
В зависимости от заданной степени обессоливания воды проектируют одно-, двух и трех ступенчатые ионнообменные установки. Остаточное солесодержание при одноступенчатом ионообменном опреснении составляет 20 мг/л. Для получения воды с солесодержанием до 0,5 мг/л применяют установки с двухступенчатой схемой Н+ - и ОН- – ионирования.
Ионообменный способ опреснения воды имеет ряд достоинств: простота оборудования, малый расход исходной воды на собственные нужды (15—20% производительности установки), малый расход электроэнергии, малый объем ных сбросных вод.
Недостаток ионообменного метода — сравнительно высокий расход реагентов, технологическая сложность процесса, который лимитируется исходным уровнем солесодержания обрабатываемой воды, определяющегося экономическими затратами. Рентабельность ионного обмена при опреснении воды обычно ограничивается исходным содержанием растворенных солей 1.5—2.5 г/л. Однако при необходимости, когда себестоимость воды не играет существенной роли, этим методом можно опреснять воду с достаточно высоким солесодержанием.
Обратный осмос
При опреснении воды методом обратного осмоса морскую воду пропускают через полупроницаемые мембраны под воздействием давления, существенно превышающего разницу осмотических давлений пресной и морской воды (для морской воды 25-50 атм.). Такие мембраны изготавливаются отечественной промышленностью из полиамида или ацетата целлюлозы и выпускаются в виде полых волокон или рулонов. Через микропоры этих мембран могут свободно проникать небольшие молекулы воды, в то время как более крупные ионы соли и другие примеси задерживаются мембраной.
Обратный осмос используется в нашей стране с начала 1970 годов в различных технологиях очистки воды от примесей, в том числе для опреснения воды. Современные промышленные установки обратного осмоса включают фильтр тонкой очистки воды, систему реагентной подготовки, насос высокого давления, блок фильтрующих модулей, блок химической промывки.
В установках по опреснению воды методом обратного осмоса трубы изготавливают из пористого материала, выложенного с внутренней стороны пленкой из ацетата целлюлозы, выполняющей функции полупроницаемой мембраны. Опреснительная установка состоит из множества аналогичных труб, уложенных параллельно друг другу, через которые насосом высокого давления (5—10 Мн/м2, или 50—100 бар) непрерывно прокачивается морская вода, а отводится два потока —обессоленная - пермеат, и вода с концентрированными солями - концентрат, которая сливается в сток (рис. 5). Поток пресной воды через мембрану пропорционален приложенному внешнему давлению. Максимальное давление определяется собственными характеристиками обратноосмотической мембраны. При слишком высоком давлении мембрана может разорваться, забиться присутствующими в воде примесями или пропускать слишком большое количество растворенных солей. При слишком низком давлении процесс замедляется.
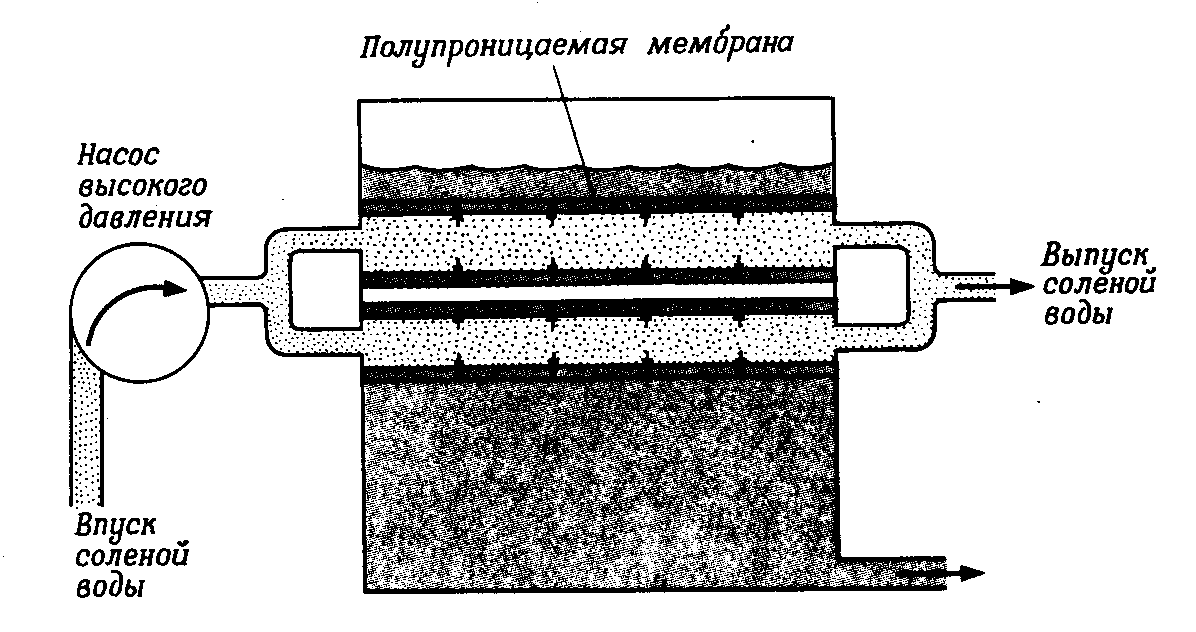
Рис. 5. Схема процесса опреснения воды методом обратного осмоса.
Обратный осмос обладает существенными преимуществами по-сравнению с другими методами опреснения воды: энергетические затраты сравнительно невелики, установки конструктивно просты и компактны, работа их может быть легко автоматизирована. Управление системой обратного осмоса осуществляетсяв полуавтоматическом и автоматическом режиме. Для уменьшения образования нежелательных отложений солей в полостях труб применяются ингибиторы осадкообразования. Для снятия осадков солей с поверхности мембран используется система химической промывки. Для контроля качества очистки воды и значения рН — проточные измерители солесодержания и рН-метры. Контроль расхода пермеата и концентрата осуществляется проточными расходомерами.
Степень опреснения воды и производительность мембраны по опресненной воде зависят от различных факторов, прежде всего от общего солесодержания исходной воды, а также солевого состава, давления и температуры. Так, при опреснении соленой воды из скважины, содержащей 0,5% растворенных солей, при давлении 50 атм в течение суток удается получить приблизительно 700 л пресной воды с 1 м2 мембраны. Поскольку для получения большой площади поверхности необходимо очень много тонких труб, процесс обратного осмоса не находит широкого применения для получения больших количеств пресной воды. Однако этот процесс представляется весьма перспективным, если в будущем будут разработаны улучшенные низконапорные высокоселективные энергосберегающие мембраны, особенно для опреснения соленой воды из скважин. Эта вода имеет более низкую концентрацию растворенных солей по сравнению с морской водой, что позволяет проводить ее опреснение при более низких давлениях.
Электродиализ
Данный процесс мембранного разделения основан на способности ионов растворённых в воде солей перемещаться через мембрану под действием градиента электрического поля. При этом катионы перемещаются по направлению к отрицательному электроду (катоду), а анионы движутся в противоположном направлении к положительно заряженному электроду (аноду). Катионы и анионы разделяют, используя специальные проницаемые для ионов ионоселективные мембраны. В результате в ограниченном мембранами объёме, происходит снижение концентрации солей.
Ионноселективные мембраны, применяемые для электродиализа, изготовляют из термопластичного полимерного материала (полиэтилен, полипропилен) и ионообменных смол (КУ-2, ЭДЭ-10П и др.) в виде гибких листов прямоугольной формы. Они имеют большую механическую прочность, высокую электропроводность и высокую проницаемость для ионов. Кроме того, они обладают высокой селективностью и низким электросопротивлением, которое составляет от 2 Ом/см2 до 10 Ом/см2 на единицу поверхности ионообменной мембраны. Срок службы мембран в среднем 3-5 лет.
Электродиализные опреснители представляют собой многокамерные аппараты фильтр-прессового типа, состоящие из камер, ограниченных с одной стороны катионитовой, с другой — анионитовой мембранами, разделяющими объём аппарата на множество полостей. Камеры размещены между катодом и анодом, к которым подведён постоянный электрический ток (рис. 6).
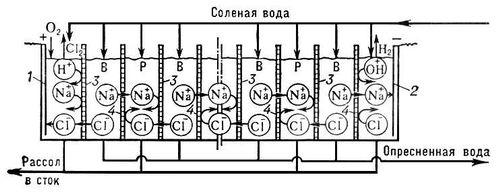
Рис. 6. Схема многокамерного электродиализного опреснителя: 1 — анод; 2 — катод; 3 — анионитовая мембрана; 4 — катионитовая мембрана; В — опресняемая вода; Р — рассол.
Опресняемая вода поступает в опреснительные камеры, где под действием электрического поля катионы и анионы растворённых в воде солей движутся в противоположных направлениях к катоду и аноду соответственно. Поскольку катионитовые мембраны проницаемы в электрическом поле для катионов, но непроницаемы для анионов, а анионитовые мембраны проницаемы для анионов, но непроницаемы для катионов, в опреснительных камерах происходит селективное разделение определённых типов ионов солей. При этом удаляемые из воды соли концентрируются в рассольных камерах, откуда они удаляются вместе с промывочной солёной водой.
Расход электроэнергии на опреснение воды электродиализом зависит от исходного солесодержания опресняемой воды (2 вт·ч на 1 л при опреснении воды с солесодержанием 2,5—3 г/л и 4—5 вт· ч на 1л при опреснении воды с содержанием солей 5—6 г/л). Выход пресной воды в электродиализных установках составляет 90-95%.
В нашей стране получили распространение электродиализные опреснительные установки серии ЭДУ (ЭДУ-5, ЭДУ-50, ЭДУ-100, ЭДУ-1000), производительностью от 5 до 1000 м3 пресной воды в сутки. Они применяются для опреснения морской воды при получении питьевой и технической воды, при обессоливании сточных вод гальванического производств (гальванических стоков), для концентрирования сточных вод, содержащих ценные компоненты (например, драгоценные металлы), перед последующим извлечением этих компонентов. Чаще всего процесс электродиализа применяют для обессоливания воды, содержащей не более 10 г/л растворённых солей. В этом случае процесс электродиализа является более экономичным по сравнению с обратным осмосом и дистиляцией. При помощи электродиализа можно также концентрировать растворы. Благодаря этому электродиализ применяется при выделения хлористого натрия (NaCl) и других солей из морской воды. Электродиализ применяется также для предочистки воды для теплоэнергетических установок.
Преимуществом электродиализа по сравнению с обратным осмосом является то, что в этом процессе используются термически и химически более стойкие мембраны, что позволяет проводить процесс опреснения воды при повышенных температурах.
Замораживание
Данный метод основан на том, что в естественных природных условиях лед, образующийся из морской воды, является пресным, поскольку образование кристаллов льда при температуре ниже температуры замерзания происходит только из молекул воды (явление криоскопии). При искусственном медленном замораживании соленой морской воды вокруг центров кристаллизации образуется пресный лед гексагональной игольчатой структуры со средней плотностью 930 кг/м3. При этом в межигольчатых каналах концентрация раствора и его плотность, повышаются, и он, как более тяжелый, по мере замораживания оседает вниз. При последующей сепарации, промывки и таянии кристаллического льда образуется пресная вода с содержанием солей 500-1000 мг/л NaСl.
Замораживание морской воды проводят в кристаллизаторах (контактные, вакуумные, с теплообменом через стенку) в условиях непосредственного контакта охлаждаемого раствора с хладагентом – газообразным или жидким.
Для лучшего опреснения морского льда применяется фракционное плавление при температуре 20°С с промывкой и сепарацией кристаллов льда от маточного раствора методами фильтрования, гидравлического прессования и центрифугирования.
Данный метод применяется для концентрирования непищевых продуктов, для опреснения морской воды, концентрирования и разделения химических растворов и др. Он достаточно прост и экономичен, но требует сложного оборудования и энергоёмок. Поэтому на практике он используется чрезвычайно редко.
В нашей стране разработан газогидратный метод опреснения воды, который по аппаратурному оформлению аналогичен замораживанию со вторичным хладоагентом [23]. Этот метод основан на способности некоторых углеводородных газов (пропан, циклопропан, бутан, изобутан, этилен, фреон-31, фреон-40 и др.) при определенных температуре и давлении образовывать при взаимодействии с водой соединения клатратного типа (газогидраты) общей формулы М•nН2О (М — молекула гидратобразующего газа), с их последующей сепарацией от рассола и плавлением. В зависимости от природы газа и условий проведения процесса, газогидраты образуются из 46 молекул воды и 6 (газогидраты I) или 8 молекул (газогидраты II) газа.
Принципиальные основы газогидратного метода опреснения воды заключаются в следующем: в замораживаемую соленую воду вводят гидратобразующий газ и после формирования кристаллической фазы (газогидрата) ее отделяют от рассола, образовавшегося в результате отбора от исходной соленой воды части молекул Н2О, расходованных на образование газогидрата; кристаллы газогидрата отмывают от рассола, плавят и получают пресную воду. Выделившийся при плавлении газогидрата газ может быть рекуперирован.
Обладая всеми преимуществами контактного вымораживания, газогидратный метод выгодно отличается более высокой температурой проведения процесса, что позволяет уменьшить энергетические затраты и потери холода в окружающую среду.
Разновидностью этого метода является опреснение морской воды с помощью попутного газа из смеси бутана с пропаном. Замораживаемую морскую воду обрабатывают попутным газом; содержащие воду кристаллогидраты углеводородов образуют твёрдую кристаллическую фазу (одна молекула пропана присоединяет 17 молекул воды). Застывшую кристаллическую массу затем разделяют. Для этого достаточно снизить давление и несколько повысить температуру: углеводороды улетучиваются, остается пресная вода. После улавливания и ожижения углеводороды возвращаются в цикл.
Необходимо подчеркнуть, что при выборе метода опреснения воды следует уделять внимание наличию в морской воде дейтерия в виде тяжелой воды D2О. Соотношение между тяжёлой и обычной водой в природных водах составляет 1:5500. Разные природные воды содержат различное содержание дейтерия. Обычная водопроводная вода содержит около 100 г дейтерия на тонну воды, а морская вода от 130 до 150 г дейтерия на тонну воды.
Физико-химические свойства тяжёлой воды отличаются от таковых для обычной воды. Молекулярная масса D2O на 10% превышает массу Н2О. Такая разница приводит к существенным различиям в физических, химических и биологических свойствах тяжёлой воды. Тяжёлая вода кипит при 101.440С, замерзает при 3,820С, имеет плотность при 200С 1,105 г/см3, причём максимум плотности приходится не на 40С, как у обычной воды, а на 11,20С (1,106 г/см3). Большая прочность связи D-O, чем H-O, обусловливает различия в кинетике реакций тяжелой и обычной воды. Подвижность дейтерия D+ меньше, чем подвижность протия Н+, константа ионизации тяжёлой воды в 5 раз меньше константы ионизации обычной воды. Химические реакции и биохимические процессы в D2O значительно замедлены. В смесях тяжёлой воды с обычной водой с большой скоростью происходит изотопный обмен: Н2O + D2O = 2 HDO.
Тяжёлая вода в высоких концентрациях токсична для организма. Для животных клеток предельная концентрация 2H2O составляет 25 об.%, для клеток растений – 50 об.%, для простейших – 70-80%. Поэтому целесообразно проводить тщательный контроль изотопного состава получаемой пресной воды.
Таким образом Выбор метода и технологии опреснения воды зависит от предъявляемых к воде требований по качеству и солесодержанию, а также технико-экономических показателей. В зависимости от реализуемого способа опреснения воды применяются различные типы опреснительных установок. Дистилляционные опреснительные установки (однокорпусные и многокорпусные, по способу опреснения - парокомпрессионные и солнечные) применяются при опреснении морской воды и солёных вод с высоким солесодержанием до 35 г/л. Опреснение морской воды электродиализом и гиперфильтрацией (обратным осмосом) экономично при солесодержании 25 г/л, ионным обменом - менее 25 г/л. Из всего объёма получаемой в мире опреснённой воды 96% приходится на долю дистилляционных опреснительных установок, 2,9% - электродиализных, 1% - обратноосмотических и 0,1% - на долю замораживающих и ионообменных опреснительных установок.
Главная задача опреснения воды заключается в том, чтобы проводить процесс с минимальной затратой энергии и минимальными расходами на оборудование. Это требование важно потому что страна, которая вынуждена в большей мере полагаться на опресненную воду, должна выдерживать экономическую конкуренцию с другими странами, располагающими более обширными и дешевыми источниками пресной воды.
Проектные разработки показывают, что транспортировка пресной воды из естественного источника даже на расстояние до 400—500 км дешевле опреснения только для небольших водопотребителей. Оценка прогнозных эксплуатационных запасов солоноватых и соленых подземных вод в засушливых районах с учетом удаленности большинства из них от естественных пресноводных источников позволяет сделать вывод о том, что опреснение является для них единственно возможным и экономически оправданным способом водообеспечения.
Применяемые в технике опреснения соленых вод методы могут быть эффективно использованы для возвращения природе использованной воды, не ухудшающей состояния пресных водоемов.
Литературные источники:
Мосин O.В. Физико-химические основы опреснения морской воды
// Сознание и физическая реальность, 2012, № 1, с. 19-30.
При использовании материалов сайта ссылка на авторство обязательна.
Тахир Худиев
Меня интересует методика отделения морского песка от водяной массы
цитирую Вашу статью: "... Он достаточно прост и экономичен, но требует сложного оборудования и энергоёмок..."
ЧТО?
Протиевую воду можно отделить от дейтериевой и от растворённых солей Быстрым замораживанием, благодаря использованию промежуточного твёрдого хладоносителя из любого материала. Лучше всего подходит алюминий. Если алюминиевую чашку, охлаждённую морозным воздухом до минус 30-ти, опустить на мгновение в прорубь (вода при нуле градусов), то на дно намёрзнет вода, в которой и дейтерия-то станет вдвое меньше от содержания его в исходной воде. Это доказано экспериментально на водопроводной воде. Из теории следует, что, если в проруби вода морская, то на дно чашки намёрзнет пресный лёд, поскольку подвижность ионов протия Вдвое больше подвижности ионов дейтерия И в 20 РАЗ больше подвижности солевых ионов.
Благодаря даровому природному холоду и использованию промежуточного твёрдого концентратора холода, возможно массовое производство питьевой (и поливной) воды с пониженным содержанием дейтерия (и солей).
Заставьте крупинки соли в воде стать намагниченными: сделайте соль — магнитом (!), и после этого «выньте» ее из воды с помощью обычных электромагнитов…
И вы вполне можете сделать соль магнитом определенными методами. «Сделайте соль — магнитом!» И тогда у вас появится система, когда вы сможете «на ходу», в режиме реального времени, выполнять опреснение без необходимости нагрева и без больших водоемов: На входе — соленая вода, на выходе — пресная! И вы пропустите воду через эту установку 2-3 раза, и в конце процесса на выходе будет свежая пресная вода!..
Всего лишь просто сделайте соль намагниченной, и извлеките эту соль электромагнитами!
Часть ченнелинга от Крайона.
МАГАДАН НА СВЯЗИ