Изотопный состав воды и происхождение жизни
© Игнатов И., Мосин О.В.
Доктор наук, проф. И. Игнатов (Болгария)
к.х.н. О.В. Мосин (Россия)
Контакт с автором: mosin-oleg@yandex.ru
Аннотация
В статье обсуждается значение воды и изотопный состав водной среды в процессе эволюционного происхождения жизни. Рассмотрен синтез наиболее важных органических молекул аминокислот, протеинов и нуклеиновых кислот из неорганических молекул, а также реакции, протекающих в водной среде древней Земли. Высказано предположение, что в условиях первичной бескислородной атмосферы, лишенной озонового слоя, под воздействием геотермальной энергии, коротковолнового ультрафиолетового излучения Солнца и мощных искровых разрядов, в гидросфере древней Земли могла образовываться и накапливаться HDO, физико-химические свойства которой значительно отличаются от свойств обычной воды.
Этот факт может наложить существенный отпечаток на представления о ранних этапах происхождения жизни. Авторами были получены при росте на тяжеловодородных средах различные адаптированные к максимальным концентрациям тяжёлой воды клетки микроорганизмов, весь биологический материал которых вместо водорода содержит дейтерий. Их дальнейшее изучение позволит дать ответ на вопрос как функционируют дейтерированные молекулы жизненно-важных соединений в условиях первичной гидросферы и водных сред, в которых все атомы водорода замещены на дейтерий.
О зарождении жизни в горячей минеральной воде с дейтерием
Многочисленные научные данные свидетельствуют о том, что жизнь зародилась в водной среде [1]. За последние десятилетия, используя разные источники энергии, в лабораторных условиях из неорганических веществ были синтезированы самые разнообразные органические соединения – аминокислоты, протеины, нуклеозиды и др. [2]. В этих опытах моделировались условия первичной бескислородной атмосферы, в которой был возможен синтез органических молекул из неорганических за счет энергии коротковолнового ультрафиолетового излучения Солнца, энергии электрических разрядов и других геотермальных источников энергии [3].
Первые эксперименты по неорганическому синтезу органических веществ в условиях первичной бескислородной атмосферы, были проведены в 1959 году американским ученым С. Миллером [4]. Смесь воды и газов – водорода (Н2), метана (CH4), аммиака (NH3) и монооксида углерода (CO), находящаяся в замкнутом сообщающемся сосуде, подвергалась воздействию электрических разрядов при температуре кипения воды. В ходе реакции из исходных неорганических веществ синтезировались органические соединения – альдегиды и аминокислоты. Опыты обнаружили, что 10—15 % углерода перешло в органическую форму. Около 2 % углерода детектировалось в виде аминокислот, самым распространённым из которых оказался глицин. Первичный анализ показал наличие в реакционной смеси 5 аминокислот. Однако, более полный повторный анализ, проведеный в 2008 году, показал образование в реакционной смеси 22 аминокислот, содержащих от 5 до 20 атомов в молекуле (рис. 1) [5]. Наряду с аминокислотами в реакционной смеси также были обнаружены сахара, липиды и предшественники нуклеиновых кислот - нуклеозиды.
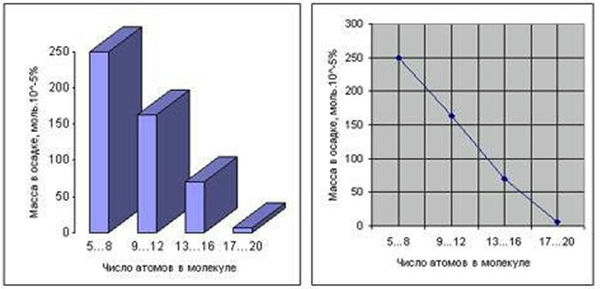
Рис. 1. Распределение соединений, полученных в экспериментах Миллера, по массе и числу атомов углерода в молекуле (диаграммы построены по данным С. Миллера [4, 5])
Эксперименты Миллера вызвали большой интерес среди учёных всего мира. К аналогичным опытам приступили другие исследователи. В 1960 году Уилсон [6] при обработке искровым разрядом паров воды (Н2О), аммиака (NH3), сероводорода (H2S), серы и золы дрожжей, получил более крупные молекулы органических полимеров, содержащих 20 и более атомов углерода. Эти полимеры в водной среде формировали тонкие пленки, с площадью поверхности около 1 см2, представляющие собой поверхностно-активные вещества, сконцентрированные на поверхности раздела вода - воздух (рис. 2). Предполагается, что эти пленки молекул полимеров, синтезировавшихся на границе между разными фазами, играли важную роль на ранних стадиях эволюции первых организованных мембраноподобных структур. Катализатором их образования могла служить сера и ее производные, которые были широко распространены на первобытной Земле в форме зерен сульфидов, встречающихся, например, в пиритовых песках.

Рис. 2. Тонкие плёнки органических полимеров, образующихся при искровых разрядах в смеси паров воды (Н2О), аммиака (NH3), сероводорода (H2S), серы и золы дрожжей [6].В 1969 году Поннамперума и сотр. провели эксперименты, аналогичные экспериментам Миллера, используя в качестве источника энергии ультрафиолетовое излучение [7]. Хотя по теоретическим соображениям синтезы, идущие под воздействием ультрафиолетового излучения, не должны принципиально отличаться от тех, которые индуцируются электрическим разрядом, было важно получить экспериментальное подтверждение этого факта, поскольку в условиях первичной атмосферы гораздо больше энергии поступало с ультрафиолетовым излучением. Как ожидалось, исследователи не только смогли синтезировать аминокислоты и пурины, т. е. строительные блоки белков и нуклеиновых кислот, но также смогли синтезировать из этих блоков полимеры [8]. Аминокислоты полимеризовались в пептидные цепи в присутствии катализатора – цианистого водорода – HCN. При дальнейшей обработке реакционной смеси фосфорной кислотой (Н3РО4) в водной среде синтезировались нуклеотиды.
Предполагается, что в условиях восстановительной атмосферы небольшие органические молекулы могли синтезироваться за счет энергии ультрафиолетового излучения Солнца. Однако условия на Земле в эпоху бескислородной атмосферы для первых органических систем были довольно жёсткими. Хотя первые организмы в бескислородной атмосфере не подвергалась окислению, ничто не защищало их от губительного воздействия жесткого ультрафиолетового излучения. Поэтому необходимо учитывать, что для синтеза органических молекул могли использовались другие истчники энергии. За счет высокоэнергетического ультрафиолетового излучения Солнца могли синтезироваться малые органические молекулы и свободные радикалы. Для синтеза из малых молекул других, более сложных соединений могли использоваться геотермальные источники энергии. Так, в растворах формальдегида с гидроксиламином, формальдегида с гидразином и в растворах, содержащих цианистый водород, после нагрева реакционной смеси в конце опыта обнаруживались аминокислоты [9]. В других экспериментах эти продукты полимеризовались в пептидные цепи, что является важным этапом на пути к неорганическому синтезу белка. В реакционной смеси с раствором цианистого водорода (HCN) в водном аммиаке (NH3) также образовывались более сложные соединения, входящие в состав нуклеиновых кислот – азотистые основания пурины и пиримидины, изображенные на рис. 3 [10].
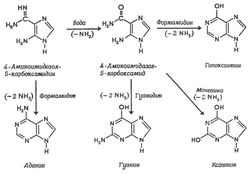
Рис. 3. Предполагаемые механизмы образования пуринов – аденина, гуанина и ксантина из водной смеси аммиака и цианистого водорода (вверху) и аденина из водной смеси аммиака и цианистого водорода (внизу). (суммарная реакция: 5HCN = аденин) [10]. Промежуточные продукты синтеза – 4-аминоимидазол-5-карбоксамидин и 4-аминоимидазол-5-карбоксамин детектировались в растворе.
Полученные результаты продемонстрировали возможный путь перехода от синтеза малых органических молекул за счет энергии ультрафиолетового излучения Солнца к более сложным органическим молекулам, образующимся при менее жестких термических воздействиях. Это очень важно для формирования представлений о ранней эволюции первых форм жизни. Важную роль в этом процессе играли молекулы жизненно-важных соединений – протеинов и нуклеиновых кислот. Как известно, молекулы протеинов построены из одной или нескольких полипептидных цепей, состоящие из большого числа различных аминокислот. Их последующая конденсация в полипептидные цепи может произойти в определённых условиях, после их образования. Важным фактором в реакции конденсации двух молекул аминокислот является выделение молекулы воды. Поскольку реакция поликонденсации аминокислот сопровождается дегидратацией, при удалении воды из системы скорость реакции увеличивается. Этот факт свидетельствует о том, что раннее развитие жизни происходило вблизи действующих вулканов, поскольку в ранние периоды геологической истории вулканическая деятельность происходила более активно, чем в последующие геологические времена. Однако дегидратация сопровождает не только полимеризацию аминокислот, но и объединение других блоков в более крупные органические молекулы, а также полимеризацию нуклеотидов в нуклеиновой кислоты. Такое объединение всегда связано с реакцией конденсации, при которой от одного блока "отщепляется" протон Н+, а от другого - гидроксильная группа ОН- с образованием молекулы Н2О [11].
Первым возможность существования реакций конденсации-дегидратации в условиях первичной гидросферы доказал Кальвин в 1965 году [12]. Из всех соединений только синильная кислота (HCN) и ее произодные - цианамид (HNCN2) и дицианамид HN(CN)2 обладают дегидратирующей способностью и способностью катализировать процесс связывания молекулы воды первичной гидросферы [13]. На присутствие синильной кислоты в первичной гидросфере указывают и ранние эксперименты Миллера. Химические реакции с синильной кислотой и ее производными сложны, их механизм окончательно не выяснен. Как показано на рис. 4, в присутствии синильной кислоты и цианамидов конденсация отдельных блоков, сопровождаемая дегидратацией, может идти при нормальных температурах в сильно разбавленных водных растворах.
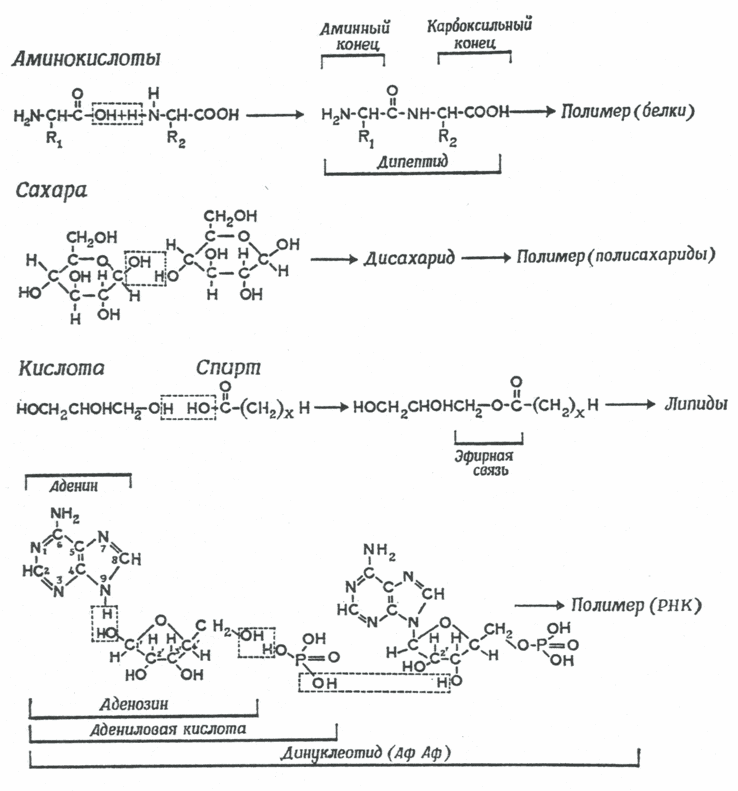
Рис. 4. Реакции конденсации и дегидратации, приводящие к образованию из отдельных молекул более крупных органических молекул. Верхние три уравнения: конденсация и последующая полимеризация аминокислот в протеины, сахаров в полисахариды и кислот и спиртов в липиды. Нижнее уравнение - конденсация аденина с рибозой и фосфорной кислотой, приводящая к образованию нуклеотида [12].
Ракции поликонденсации аминокислот в присутствии синильной кислоты и ее производных зависят от кислотности водных растворов, в которых они протекают [14]. В кислых водных средах (рН 4-6) эти реакции не идут, тогда как щелочные условия (рН 8-9) способствуют их протеканию. До сих пор не существует однозначного мнения, имел ли первичный океан щелочной состав, но вероятно, что именно таким значением рН обладала озерная вода, соприкасавшаяся с базальтом, и эти реакции могли происходить при контакте воды с базальтовыми породами.
В модельных условиях первичной гидросферы безводную смесь аминокислот подвергали воздействию температур от 600С до 1700С с образованием коротких протеинов. При этом наилучшие результаты по поликонденсации получались со смесями аминокислот, содержащими аспарагиновую и глутаминовую кислоты [15]. Эти аминокислоты относятся к числу незаменимых аминокислот, встречающихся во всех современных организмах. В процессе синтеза из них образовывались соединения сходные с природными белками, впоследствии названные протеиноидами. Они состояли из крупных молекул с молекулярной массой до 300000, состоящих из тех же аминокислот, что и природные белки. По количественному составу они содержат 18 из 22 аминокислот, обычно встречающихся у современных организмов, что сооответствует общему определению белка. С природным белком протеиноиды сходны и по ряду других важных свойств, например по связыванию полинуклеотидов, по пригодности в пищу бактериям и крысам, по способности вызывать реакции, сходные с теми, которые катализируются ферментами в живых организмах. Так, эти искусственно синтезированные органические соединения способны каталитически разлагать глюкозу [16] и оказывать действие аналогичное действию меланоцитстимулирующего гормона [17].
Другим важным свойством протеиноидных соединений является их гетерогенность. Это означает, что последовательность аминокислот в их пептидных цепях не случайна, а, напротив, закономерна. Но в то время было невозможно провести точное сравнение этих искусственных соединений с природными белками, так как молекулы белков настолько сложны, что структура многих из них еще не определена с достаточной точностью. Чтобы подчеркнуть сходство этих искусственных белковоподобных соединений с природными белками, они были названы протеиноидами [18]. Поскольку они были синтезированы под действием тепла, в дальнейшем их стали обозначать "термическими протеиноидами".
За последние годы много было сделано для изучения структуры и свойств протеиноидов. Если промыть горячую смесь протеиноидов водой или водными растворами солей, в водной среде образуются элементарные мембраноподобные микросферы [19]. Размер микросфер очень мал, их диаметр составляет около 5-10 мкм. По морфологическим особенностям микросферы напоминают мембрану клетки (рис. 5).
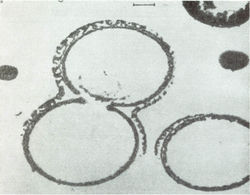
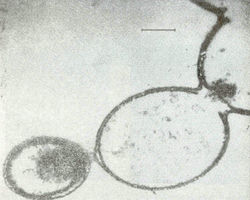
Рис. 5. Электронные микрофотографии протеноидных микросфер в водной среде [19].Образование протеноидных микросфер из смеси искусственных протеинов важно поскольку дает материал для суждения о том, как мог произойти следующий этап эволюции жизни. Это этап от разрозненных органических молекул к группам организованных молекул - коацерватам, собранным в отдельные структуры и отделенными от окружающего мира примитивной мембраной – аналогом мембраны клетки, что было впервые продемонстрировано нашим соотечественником академиком А. И. Опариным [20].
С учётом вышеназванных факторов происхождение жизни выглядит следующим образом. Начальным этапом эволюции, по-видимому, было образование в первичной гидросфере и насышенной водяными парами атмосфере при высоких температурах аминокислот и азотистых соединений – аналогов нуклеиновых кислот. Такой синтез возможен при наличии в водной среде фосфорной кислоты и воздействии электрических разрядов, ультрафиолетового излучения и высоких температур [21]. Следующий этап - поликонденсация аминокислот в протеиноиды при температурах 65-1700С. Реакция поликонденсации происходит в присутствии фосфатов, если в водной смеси имеется достаточные количества аспарагиновой и глутаминовой кислот. Затем в смеси протеиноидов при воздействии на них водой или кислыми водными растворами (дождем) образуются коарцерваты – предшественники первых клеток, обладающие каталитической активностью. Способность протеиноидов к выполнению некоторых функций, сходных с функциями ферментов живых организмов, выражается в том, что они могут в присутствии гидрата окиси цинка расщеплять АТФ, т. е. обладают слабой ферментативной активностью. Впоследствие этого у микросфер в дальнейшем могла появиться способность к синтезу РНК, которые могли случайным образом кодировать короткие белки.
Важную роль в происхождении жизни, по-видимому, играл самый распространённый минерал земной коры кварц SiO2. Кристалл кварца обладает тетраэдрической структурой, из которой могут складываются различные цепочечные и ленточные переплетающиеся друг с другом силикатные структуры. Уникальность кварца заключается в том, что его кристаллы оптически активны, т. е. способны взаимодействовать с поляризованным светом. Но кристаллы кварца не просто воздействуют на проходящий через них свет, они также обладают оптически активными свойствами на поверхности кристалла. Поэтому, на поверхности L- и D- энантиомерных кристаллов кварцев была возможна избирательная абсорбция L- и D-изомеров, что может объяснить стереоселективность эволюции.
Другим интересным свойством кварца является то, что его структура удивительным образом напоминает структуру самой воды (рис. 6). Еще первооткрыватели водородных связей Дж. Бернал и Р. Фаулер в 1932 г. сравнивали структуру жидкой воды с кристаллической структурой кварца, а ассоциаты воды рассматривались как тетрамеры 4Н20, в которых четыре молекулы воды соединены в тетраэдр с двенадцатью внутренними водородными связями, в результате образуется четырёхгранная пирамида – тетраэдр, т.е. воде свойственна квазикристаллическая сруктура [22].
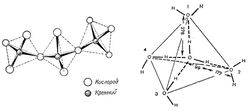
Рис. 6. Кристаллическая структура кварца (слева) и тетраэдрическая структура воды (справа).По мнению некоторых исследователей [23] водородные связи в водных тетрамерах могут образовывать как право- так и левовинтовую последовательности, аналогично тому, как кристаллы кварца существуют в право- и лево-вращательной кристаллической формах. Так как каждый такой тетрамер воды имеет еще и четыре незадействованные внешние водородные связи, то тетрамеры могут соединяться этими внешними связями в своего рода полимерные цепочки, наподобие молекулы ДНК (рис. 7). Поскольку внешних связей всего четыре, а внутренних - в три раза больше, то это позволяет тетрамерам в жидкой воде изгибать, поворачивать и даже надламывать эти ослабленные тепловыми колебаниями молекул воды внешние водородные связи. Согласно этому предположению это и обуславливает текучесть воды.
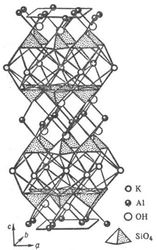
Рис. 7. Фрагмент слоистой кристаллической структуры минерала мусковита KAl2(AlSi3O10.OH)2, иллюстрирующий переслаивание алюмокремне-кислородных сеток с полиэдрическими слоями крупных катионов Al3+ и K+, напоминающие двухцепочечную структуру ДНК.Предполагаемая структура воды могла быть обусловлена ее древней реологической связью с кварцем и другими кремнекислородными минералами, преобладающими в земной коре, в контакте с которыми пребывала вода. С кальциево-силикатными породами связано и развитие древнейших форм жизни на Земле. Самые древние доказательства существования живых организмов со слоистой известковой структурой на Земле датируются 3,5 миллиардами лет. Эти древнейшие известковые (доломитовые) ископаемые докембрийского периода – строматолиты, которые строили свой скелет из известняка и диоксида кремния SiO2. Строматолиты формировались на дне неглубоких водоемов в архее в самую древнюю геологическую эпоху Земли — 2,5−3,5 млрд лет назад. Изучение этих образований очень важно и интересно, так как строматолиты хранят в себе сведения о зарождающейся жизни на Земле и органическом составе первых живых организмов – многочисленных колоний цианобактерий, диатомовых водорослей и нефтеперерерабатывающих бактерий, возникающих в толщах известняков и доломитов в жерлах погасших вулканов и термических источников. Эти планктонные формы обитают в верхних слоях морской воды вместе с другими организмами, обладающими известковыми (фораминиферы) и хитиновыми панцирями. Размер организмов с кремниевым скелетом достигает несколько десятков микрометров. После смерти эти организмы опускались на морское дно, причём вещество их скелета химически взаимодействовало с морской водой. Карбонат кальция фораминифер и хитин других планктонных микроорганизмов растворялись в воде лучше, чем кремнезём диатомовых водорослей и радиолярий, формируя осадки кремнезёма. Кремнистые сланцы с отложениями этих кремнийсодержащих микроорганизмов формировались в эпоху фанерозоя в глубоких океанских впадинах, на глубинах около 2-3 км. Временный расцвет организмом с кренезёмным скелетом мог привести к такому скоплению кремния в водах океана. Затем двуокись кремния могла кристаллизоваться вокруг рассеянных в известняке центров кристаллизации, постепенно замещая молекулы карбоната кальция. Позднее, организмы, обладающие известковыми панцирями - фораминиферы стали абсорбировать кальций из известняковых пород.
Новые достижения в области исследования воды и её структуры дают возможность лучше анализировать условия, при которых зародилась жизнь. Трудно допустить, что жизнь могла возникнуть в «хаотической» воде [24]. Живые организмы и вода являются сложными, самоорганизующимися системами со свойственной им структурой. Самыми благоприятными для зарождения жизни на Земле являются минеральные воды, которые взаимодействают с карбонатом кальция, а затем морские воды. При этом самоорганизация первичных органических соединений в водной среде поддерживалась термальной энергией магмы, вулканической деятельностью и солнечной активностью. Так, циркулирующие в недрах по трещинам, пустотам, каналам и пещерам карстовые воды содержат карбонат кальция, активно взаимодействуют с живой материей и содержат информацию о жизни в более позднем геологическом периоде.
Другой главный вопрос эволюции жизни – структура самой воды, участвующей в образовании жизни. Как показали совместные исследования, проведенные в Болгарском научно-исследовательском центре медицинской биофизики, отдельные клетки и ткани организма являются “датчиками” структурированного состояния воды, чутко реагирующими на изменения ее структуры. В зависимости от энергетических состояний живые организмы могут или получать различные виды энергии из окружающей среды (режим «приема»), или наоборот терять ее (режим «отдачи»). Вероятно, в этих двух режимах происходят изменения структуры водяных ассоциатов – кластеров с общей формулой (Н2О)n, где количество молекул воды n может достигать сотен и даже тысяч единиц. Поэтому передача информации между отдельными клетками может осуществляться и за счет информационных свойств воды.
Таким образом, в настоящее время существует много научных данных, подтверждающих структурирующую роль воды при возникновении клеточной самоорганизации и ранних форм жизни в условиях первичной гидросферы, в которой был возможен синтез органических молекул из неорганических. Однако, с геологической точки зрения результаты этих исследований часто не являются удовлетворительными из-за сложности моделирования геологического процессов прошлого. Поэтому многие вопросы происхождения жизни остаются до сих пор неизученными, например, изотопный состав первичной гидросферы. Как было показано авторами раннее [25], в первичной гидросфере в условиях геотермальной активности и искровых разрядов в водной среде могли образовываться и накапливаться некоторые количества тяжёлой воды (D2O). В первичной атмосфере Земли не было защитного кислородно-озонового слоя, способного защитить поверхность Земли от жёсткого коротковолнового излучения Солнца, несущего огромную энергию. Поэтому излучение свободно проходило через бескислородную атмосферу и достигая гидросферы, вызывало фотолиз воды. Энергия излучения, вулканические геотермальные процессы на горячей поверхности Земли и электрические разряды в атмосфере, могли явиться результатом обогащения гидросферы дейтерием в виде тяжёлой воды, которая испаряется медленнее обычной воды. В смесях с D2O обычной водой происходит изотопный обмен с образованием “полутяжелой” воды (HDO): H2O + D2O = 2HDO. Поэтому при низких концентрациях дейтерий присутствует в воде в форме HDO, а при высоких – в форме D2O.
Тяжёлая вода по химическому составу представляет собой оксид дейтерия D2O с кислородом природного изотопного состава 16О. Строение молекул D2O такое же, как молекул Н2O, с очень малым различием в значениях длин ковалентных связей и углов между ними. Молекулярная масса D2O (20,0276 г/моль) на 10% превышает массу Н2O (18,0153 г/моль). Разница в молекулярных массах D2O и Н2O приводит к существенным различиям в физических, химических и биологических свойствах тяжёлой воды (таблица 1). Тяжёлая вода кипит при 101,440С, замерзает при 3,820С, имеет плотность при 200С 1,1053 г/см3, причём максимум плотности приходится не на 40С, как у обычной воды, а на 11,20С (1,1060 г/см3). Большая прочность связи D-O, по сравнению с Н-О, обуславливает различия в кинетике реакций тяжёлой и обычной воды. Согласно теории абсолютных скоростей разрыв СH-связей может происходить быстрее, чем СD-связей, подвижность иона D+ меньше, чем подвижность Н+, константа ионизации тяжёлой воды меньше константы ионизации обычной воды. Эти эффекты отражаются на кинетике химической связи и скорости химических реакций в тяжёлой воде. Протолитические реакции и биохимические процессы в D2O значительно замедлены. Однако, существуют и такие реакции, скорость которых в тяжёлой воде выше, чем в Н2O. В основном это реакции, катализируемые ионами D+ или H+ или OD- и ОН-. Эксперименты с тяжёлой водой показали, что клетки животных способны выдерживать до 25-30% D2O, растений 60% D2O, а клетки простейших микроорганизмов способны жить на 90% D2O [26].
Таблица 1. Физические свойства обычной и тяжёлой воды
Физические свойства
D2O
H2O
Молекулярная масса (г/моль)
20,0276
18,0153
Плотность при 20 0C (г/см3)
1,1053
0,9982
Температура максимальной плотности, °C
11,24
3,98
Температура замерзания при 1 атм, °C
3,82
0
Температура кипения при 1 атм, °C
101,44
100
Давление пара при 100 °C, мм. рт. ст.
721,60
760,00
Вязкость при 20 °C, сантипуаз
1,247
1,002
В составе природной воды дейтерий образует 6 конфигураций изотопологов - HD16O, HD17O, HD18O, D216O, D217O, D218O, 3 конфигурации образованы изотопологами кислорода - Н216O, Н217O, Н218O. Массовые концентрации изотопологов воды в природных водах, рассчитанные на основании данных определения их содержания методом ИК-спектроскопии, варьируют в пределах, зафиксированных в основных стандартах изотопного состава гидросферы Standard Marine Ordinary Water (SMOW) (таблица 2).
Таблица 2. Рассчитанные массовые концентрации изотопологов в природной воде, соответствующие международному стандарту SMOW
Изотополог воды
Молекулярная масса
Содержание, г/кг SMOW
1H216O
18,0106
997,03253636
1HD16O
19,01684
0,32800009
D216O
20,0231
0,00002690
1H217O
19,0148
0,41150907
1HD17O
20,0211
0,00013499
D217O
21,0273
0,00000001
1H218O
20,0148
2,22706373
1HD18O
21,0211
0,00072876
D218O
22,0274
0,00000005
Как видно из таблицы 2, в природной воде суммарная массовая концентрация тяжёлых изотопологов D, 17O и 18O может достигать 2,97 г/кг, что является значительной величиной, сопоставимой с концентрацией минеральных солей в воде. В природных водах в 10000 молекул в среднем содержится 9973 молекул H216O, 3 молекулы HD16O, 4 молекулы H217O, 20 молекул H218O и около 2 молекул D2O [27].
По международному стандарту SMOW, соответствующему глубинной воде Мирового океана, которая весьма стабильна по изотопному составу, абсолютное содержание D и 18O в океанической воде составляет: D SMOW/1H SMOW=(155,76±0,05)×10−6 (155,76 ppm), 18O SMOW/16O SMOW =(2005,20±0,45)×10−6 (2005 ppm) [28]. Для международного стандарта природной воды из Антарктики SLAP концентрации в воде составляют: для D D/H=89×10−6 (89 ppm), для 18O - 18O/16O=1894×10−6 (1894 ppm). Содержание самого лёгкого изотополога H216O в воде, соответствующей по изотопному составу SMOW, составляет 997,0325 г/кг (99,73 мол.%), а по изотопному составу SLAP - 997,3179 г/кг (99,76 мол.%). В поверхностных водах отношение D/(H+D)=(1,32-1,51).10-4, в прибрежной морской воде D/(H+D)=(1,55-1,56).10-4. Для природных вод чаще всего характерны отрицательные отклонения от SMOW на (1,0-1,5) .10-5, в отдельных случаях до (6,0-6,7) .10-5, но встречаются и положительные отклонения до 2,0.10-5.
Заключение
Наличие D2O в первичной гидросфере может привести к пересмотру представлений о ранней эволюции жизни на нашей планете. В природных водах соотношение между тяжёлой и обычной водой составляет 1:5500. Гравитационное поле Земли – недостаточно сильно для удержания водорода, и наша планета постепенно теряет водород в результате его диссоциации в межпланетное пространство. Водород улетучивается быстрее тяжелого дейтерия. Поэтому в результате этого природного процесса фракционирования изотопов в течение всей эволюции Земли должно происходить накопление дейтерия в поверхностных водах и закрытых водоемах, в то время как в атмосфере и в водяных парах содержание дейтерия остается низким. Тяжёлая вода испаряется медленнее, чем обычная вода, а конденсируется быстрее. На нашей планете осуществляется гигантский природный испарительно-конденсационный процесс разделения тяжелых изотопных разновидностей воды, играющий существенный роль в поддержании жизни на планете. При этом важным обстоятельством, является то, что углеродные связи с участием дейтерия более прочны и стабильны, чем углеродные связи с участием водорода. Изотопные эффекты, энергия связи, константа диссоциации, подвижность, длина связи для пары Н+/D- также различны. А это означает, что в первичной воде на Земле самоорганизующиеся дейтерированные структуры смогли сохраниться и существовать дольше во времени, чем протонированные формы. Есть основания предположить, что в ту эпоху существовал процесс структурирования в водной среде органических молекул, поскольку авторами было показано, что структурирующее свойства и стабилизирующее воздействие тяжёлой воды на химические связи более выражены, чем у обычной воды.
Источником дейтерия для синтеза тяжелой воды во Вселенной являются вспышки сверхновых и термоядерные процессы, происходящие внутри звёзд. Возможно этим объясняется тот факт, что мировое количество дейтерия повышается в период глобальных потеплений и изменений климата. Таким образом, дейтерий может служить своеобразным индикатором эволюции Вселенной, поскольку количество дейтерия в мире постоянно. Дейтерий образуется в результате столкновения свободного нейтрона и протона при температурах миллион градусов Цельсия. Два атома дейтерия формируют ядро гелия, состоящего из двух протонов и двух нейтронов. Вплоть до настоящего времени считалось, что на ранних этапах эволюции Вселенной в процессе формирования гелия израсходовались почти все атомы дейтерия, и лишь 10 тысяч атомов дейтерия остались неизрасходованными. Исходя из этого количества дейтерия в Космосе, природная распространённость дейтерия составляет по расчётам 0.015 ат.%.
Литература
1. J. L. Bada, Stanley Miller’s 70th Birthday. Origins of Life and Evolution of the Biosphere, Vol. 30, Kluwer Academic Publishers, Netherlands (2000), p. 107–12.
2. D. J. Brooks, J. R. Fresco, A. M. Lesk, M. Singh, “Evolution of amino acid frequencies in proteins over deep time: inferred order of introduction of amino acids into the genetic code”, Molecular Biology and Evolution, 19 (10), 1645–55 (2002).
3 A. Lazcano, J. L. Bada, “The 1953 Stanley L. Miller Experiment: Fifty Years of Prebiotic Organic Chemistry”, Origins of Life and Evolution of Biospheres, 33 (3), 235–242 (2004).
4. S. L. Miller, “A production of amino acids under possible primitive earth conditions”, Science, 117 (3046), 528–9 (1953).
5. A. P. Johnson, H. J. Cleaves, J. P. Dworkin, D. P. Glavin, A. Lazcano, J. L. Bada, “The Miller volcanic spark discharge experiment”, Science, 322 (5900), 404-412 (2008).
6. A. T. Wilson, “Synthesis of macromoleculcs”, Nature, 188, 1007-1009 (1960).
7. C. Ponnamperuma, N. Gabel, Prebiological synthesis of organic compounds, in: A. Renbaum and R. F. Landell (eds.), Chemistry in Space Research, New York (1969), p. 56-59.
8. R. S. Young, C. Ponnamperuma, Early evolution of life, B. S. C. S. Pamphlets, Heath, Boston (1964), p 29-38.
8. J. Оro, Investigation of organo-chemical evolution, in: G. Marnikunian and М. Н. Briggs (eds.), Current Aspects of Exobiology, Pergamon, London (1965), p. 13-76.
9. J. Оrо, Prebiological organic systems, in: S. W. Fox (ed.), The Origin of Prebiological Systems, Academic Press, New York (1965), p. 137-162 (Происхождение предбиологических систем, Мир, Москва (1966), с. 144).
10. T. V. Waehneldt, S. W. Fox, “The binding of basic proteinolds with organismic or thermally synthesized polynucleotides”, Biochem. Biophys. Acta, 160, 239-245 (1968).
11. A. Meister, Biochemistry of the Ammo Acids, 2nd ed., Academic Press, New York (1965), p. 119-126 (перевод 1-го издания: А. Майстер, Биохимия аминокислот, Наука, Москва (1961), с. 115.
12. M. Calvin, Chemical Evolution, Clarendon, Oxford (1969), p. 278 (М. Кальвин, Химическая эволюция, Мир, Москва (1971), с. 48-50.
13. C. N. Mathews, R. Moser, “Peptide synthesis from hydrogen-cyanide and water”, Nature, 215, 1230-1234 (1968).
14. P. Abelson, “Chemical events on the"primitive earth”, Proc. Natl. Acad. Sci. U. S., 55, 1365-1372 (1966).
15. I. Harada, S. W. Fox, “Thermal synthesis of natural ammo-acids from a postulated primitive terrestrial atmosphere”, Nature, 201, 335-336 (1964).
16. S. W. Fox, G. Krampitz, “Catalytic decomposition of glucose in aqueous solution by thermal proteinoids”, Nature, 203, 1362-1364 (1964).
17. S. W. Fox, C. T. Wang, “Melanocytestimulating hormone: Activity in thermal polymers of alpha-ammo acids”, Science, 160, 547-548 (1968).
18. S. W. Fox, Simulated natural experiments in spontaneous organization of morphological units from proteinoid, in: S. W. Fox (ed.), the Origins of Prebiological Systems, Academic Press, New York (1965), p. 361-373 (С. Фокс, Происхождение предбиологических систем, Мир, Москва (1966), 362-375.
19. M. G. Rutten, The Origin of life by natural causes, Elsevier Publishich Comp., New York (1971), p. 158.
20. А. И. Опарин, Пути начального формирования обмена веществ и искусственное моделирование этого формирования в коацерватных каплях, in: S. W. Fox (ed.), Origins of Prebiological Systems, Academic Press, New York (1965), p. 331-341 (C. Фокс, Происхождение предбиологических систем, Мир, Москва (1966), с 137).
21. S. Fox, Experiments suggesting evolution to protein, in: V. Bryson and H. J. Vogel (ed.), Evolving Genes and Proteins, Academic Press, New York (1965), p. 359-70.
22. Дж. Бернал, Возникновение жизни, Мир, Москва (1969), с. 391.
23. Ю. А. Колясников, К тайнам мироздания, СВНЦ ДВО РАН, Магадан (1997), с. 225.
24. И. Игнатов, Биоэнергетическая медицина. Зарождение живой материи, “память воды”, биорезонанс, биофизические поля, ГеяЛибрис, София (2006), с. 93.
25. О. В. Мосин. “Дейтерий, тяжелая вода, эволюция и жизнь”, Водоочистка, 10, 34-45 (2009).
26. О. В. Мосин, Д. А. Складнев, В. И. Швец. “Исследование физиологической адаптации бактерий к тяжелой воде”, Биотехнология, 10, 12-32 (2000).
27. А. И. Шатенштейн, Изотопный анализ воды, Наука, 2 изд., Москва ( 1957), с. 98.
28.G. Lis, L. I. Wassenaar, M. J. Hendry, “High-Precision Laser Spectroscopy D/H and 18O/16O Measurements of Microliter Natural Water Samples”, Anal. Chem., 80 (1), 287-293 (2008).