Горячая минеральная вода с повышенным содержанием дейтерия в процессе происхождения жизни и живой материи
© Игнатов И., Мосин О.В.
Доктор наук, проф. И. Игнатов (Болгария)
к.х.н. О.В. Мосин (Россия)
Контакт с автором: mosin-oleg@yandex.ru
Введение
Вселенная, образовавшаяся в результате “Большого взрыва” 13,7 миллиардов лет тому назад, была значительно горячее и плотнее, чем сейчас и состояла, в основном, из водорода (H). Дейтерий (D) сформировался в последующие мгновения эволюции Вселенной в результате столкновения свободного нейтрона и протона при сверхвысоких температурах. Далее два атома дейтерия вошли в состав ядра гелия (4He), состоящего из двух протонов и двух нейтронов. Таким образом, дейтерий может служить индикатором эволюции Вселенной, поскольку количество дейтерия в природе постоянно. До настоящего времени считалось, что в процессе формирования 4He израсходовались почти все атомы дейтерия, и лишь 10 000 атомов дейтерия остались неизрасходованными. Исходя из этого количества дейтерия в Космосе, природная распространённость дейтерия составляет 0,015 ат.% D (от общего числа всех атомов водорода). В 2007 году американский астроном Дж. Лински с помощью ультрафиолетового телескопа FUSE (Far Ultraviolet Spectroscopic Explorer) провёл исследование дейтерия в галактике Млечный Путь и обнаружил, что дейтерия в нём содержится значительно больше, чем об этом свидетельствовали данные предыдущих исследований [1]. В частности, на звездообразование было потрачена не 1/3, а 15% D, превратившегося затем в гелий и он распределён неравномерно. Полученные данные могут радикально изменить теоретические представления не только о процессе формировании звезд и галактик, но и молекулярной эволюции. Источником дейтерия во Вселенной являются вспышки сверхновых звёзд и термоядерные процессы, идущие внутри звёзд. Возможно, этим объясняется тот факт, что мировое количество дейтерия повышается в период глобальных потеплений и изменений климата. Гравитационное поле Земли недостаточно сильное для удержания лёгкого водорода, и наша планета постепенно теряет водород в результате его диссоциации в межпланетное пространство. Водород улетучивается быстрее тяжелого дейтерия, способного накапливаться в гидросфере Земли. Поэтому в результате этого природного процесса фракционирования изотопов в процессе эволюции Земли должно происходить накопление дейтерия в поверхностных водах, в то время как в атмосфере и в водяном паре содержание дейтерия низкое. Таким образом, на планете происходит масштабный природный процесс разделения изотопов H и D, играющий существенный роль в поддержании жизни.
Соотношение D/H (изотопные сдвиги, δ) по международному стандарту SMOW, соответствующему стабильной по изотопному составу воде Мирового океана, составляет: D/H=(155,76±0,05)×10−6 (155,76 ppm) [2]. По международному стандарту природной воды из Антарктики SLAP соотношение D/H в воде составляет D/H=89×10−6 (89 ppm). Для природных вод чаще всего характерны отрицательные отклонения от SMOW на (1,0-1,5) .10-5, в отдельных случаях до (6,0-6,7) .10-5, но встречаются и положительные отклонения до 2,0.10-5. В среднем в природных водах соотношение D/H составляет 1:5700. Дейтерий в природных водах распределен неравномерно: варьируя от 0,015 ат.% для воды из Антарктического льда, до 0,02-0,03 ат.% D для речной и морской воды. Талая вода и горная вода, полученная за счет таяния ледников содержит на 3-5% меньше дейтерия, чем обычная питьевая вода. В среднем, в 1 тонне речной воды содержится 150-300 г. дейтерия. Воды других подземных и поверхностных источников содержат разное колическтво дейтерия от δ = +5.0 D,%, SMOW (Средиземное море) до to δ = -105 D,%, SMOW (река Волга).
Раннее авторами было высказано предположение, что первичная вода на ранних стадиях эволюции содержала больше дейтерия и он был распространен неравномерно в атмосфере и гидросфере [3]. Первичная атмосфера Земли обладала восстановительными свойствами и состояла, в основном, из смеси газов – CO, Н2, N2, NH3 и CH4. В условиях восстановительной атмосферы отсутствовал защитный кислородно-озоновый слой, экранировующий поверхность Земли от жёсткого коротковолнового солнечного УФ-излучения, несущего большую энергию, способного вызвать фотолиз и радиолиз воды. Процессами, сопровождающими накопление дейтерия в гидросфере признаны радиационное излучение, вулканические геотермальные процессы и электрические разряды в атмосфере. Эти природные процессы могли явиться результатом обогащения гидросферы дейтерием в форме HDO, которая испаряется медленнее обычной воды, а конденсируется быстрее. Формирование НDO происходит в смесях D2O-H2O за счет реакций диссоциации и изотопного (H-D) обмена: H2O + D2O = 2HDO. Поэтому при низких концентрациях дейтерий присутствует в воде в форме HDO, а при высоких – в форме D2O. Строение молекул D2O такое же, как молекул Н2O, с очень малым различием в значениях длин ковалентных связей и углов между ними. D2O кипит при 101,440С, замерзает при 3,820С, имеет плотность при 200С 1,1053 г/см3 (таблица), причём максимум плотности приходится не на 40С, как у Н2O, а на 11,20С (1,1060 г/см3). Эти эффекты отражаются на энергии химической связи, кинетике и скорости химических реакций в D2O. Протолитические реакции и биохимические процессы в D2O значительно замедлены. Однако, существуют и такие реакции, скорость которых в D2O выше, чем в Н2O. В основном это реакции, катализируемые ионами D3О+ или H3О+ или OD- и ОН-.
Таблица. Физические свойства обычной и тяжёлой воды
Физические свойства
D2O
H2O
Молекулярная масса (г/моль)
20,0276
18,0153
Плотность при 200C (г/см3)
1,1053
0,9982
Температура максимальной плотности, °C
11,24
3,98
Температура замерзания при 1 атм, °C
3,82
0
Температура кипения при 1 атм, °C
101,44
100
Давление пара при 100 °C, мм. рт. ст.
721,60
760,00
Вязкость при 20 °C, сантипуаз
1,247
1,002
Согласно теории абсолютных скоростей разрыв СH-связей может происходить быстрее, чем СD-связей, подвижность иона D3О+ меньше, чем подвижность Н3О+, константа ионизации D2O меньше константы ионизации H2O. Это означает, что в первичной воде самоорганизующиеся дейтерированные структуры могли существовать дольше во времени, чем протонированные формы. Есть основания предпологать, что в ту эпоху существовал процесс структурирования в водной среде органических молекул, поскольку было показано, что структурирующее свойства и стабилизирующее воздействие D2O на химические связи из-за изотопных эффектов D несколько более выражены, чем у H2O [4]. Самые большие изотопные эффекты в разнице констант скоростей химических реакций с соотношением kh/kd = 6-8 наблюдаются в D2O для C-H/C-D, N-H/N-D и O-H/O-D связей [5].
В зависимости от того, какое положение занимает атом дейтерия в молекуле различают первичные и вторичные изотопные эффекты дейтерия, опосредованные межмолекулярными взаимодействиями. В этом аспекте наиболее важными для структуры макромолекулы являются динамические короткоживущие водородные (дейтериевые) связи. Они формируются между соседними атомами дейтерия (водорода) и гетероатомами О, С, N, S и D2O из окружающей среды и играют существенную роль в поддержании пространственной структуры макромолекул и в межмолекулярных взаимодействиях. Замещение атомов водорода дейтерием изменяет конформацию и стабильность водородных (дейтериевых) связей в макромолекулах протеинов и ДНК, способствующих поддержанию их структуры и стабильности. Связи, сформированные атомами дейтерия различаются по прочности и энергии от аналогичных водородных связей. Различия в нуклеарной массе атома H и D могут служить причиной различий в синтезах нуклеиновых кислот, которые могут приводить к структурным различиям и к функциональным изменениям в клетке. Ферментативные функции и структура синтезируемых белков также изменяются при росте клеток в D2O, что может отразиться на процессах метаболизма и деления клетки. Другое важное свойство определяется пространственной структурой D2O, имеющей тенденцию сближать гидрофобные группы макромолекул, чтобы минимизировать их эффект на водородную (дейтериевую) связь в присутствии молекул D2O. Поэтому структура макромолекул белков и нуклеиновых кислот в D2О несколько стабилизируется [6]. При помещении клеток биологических объектов в D2O, из них не только удаляется протонированная вода за счет реакции обмена Н2О-D2О, но и происходит быстрый изотопный (H-D) обмен в гидроксильных (-ОН), сульфгидрильных (-SH) и аминогруппах (-NH2) всех органических соединений, включая белки, нуклеиновые кислоты, углеводы и липиды. Известно, что в этих условиях только ковалентная С-Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С-D могут синтезироваться de novo [7].
Дейтерированные клетки различных микроорганизмов, адаптированных к максимальным концентрациям D2O в ростовых средах (95-98 об.% D) являются удобными объектами для прогнозирования условий эволюции и адаптации, а также изучения структуры и конформации клеточных природных соединений и молекулярной организации клетки методом ЯМР-спектроскопии. В процессе роста в D2O в клетках синтезируются молекулы протеинов и ДНК, атомы водорода в углеродных скелетах которых почти полностью замещены на дейтерий. Такие дейтерированные макромолекулы претерпевают структурно-конформационные изменения, необходимые для их функционирования в D2O.
Чувствительность различных биологических объектов к D2O различная. Клетки животных способны выдерживать до 25-30% D2O, растений - 60% D2O, а клетки простейших микроорганизмов - 90% D2O (рис. 1).
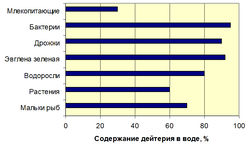
Рис. 1. Выживаемось клеток различных организмов в воде с различными содержаниями дейтерия (по данным авторов).Мы исследовали изотопные эффекты дейтерия в прокариотических и эукариотических клетках различных таксономических групп микроорганизмов, реализующих метилотрофный, хемогетеротрофный, фотоорганотрофный и биосинтетический пути ассимиляции субстратов (облигантые и факультативные метилотрофные бактерии, хемогетеротрофные бактерии, галобактерии, синезеленые водоросли) методами 1Н-ЯМР-, ИК- и масс спектрометрии. Показано, что эффекты, наблюдаемые при адаптации клетки к D2O носят комплексный многофакторный характер и связаны с изменениями морфологических, цитологических и физиологических параметров – величины лаг-периода, времени клеточной генерации, выходов биомассы, соотношения синтезируемых аминокислот, белков, нуклеозидов, сахаров и липидов при росте в D2O, а также с уровнем эволюционной организации исследуемого объекта. Общей особенностью изученных микроорганизмов при росте в D2О являляется пропорциональное увеличение продолжительности лаг-периода и времени клеточной генерации при уменьшении выходов микробной биомассы. Полученные свидетельствуют о том, что клетка реализует особые адаптивные механизмы, способствующие функциональной реорганизации работы жизненно-важных систем в D2О. Наиболее чувствительными к замене Н+ на D+ признаны аппарат биосинтеза макромолекул и дыхательная цепь, т. е. те клеточные системы, использующие высокие скорости образования и разрыва водородных связей. Данный факт позволяет рассматривать биологическое воздействие D2О как комплексное воздействие, действующему одновременно на функциональное состояние большого числа систем: метаболизм, биосинтетические процессы, транспорт веществ, структуру и функции макромолекул. Также возможно, что в процессе адаптации к D2O изменяется соотношения основных клеточных метаболитов. Кроме того, присутствие дейтерия вызывает физиологические, морфологические и цитологические изменения в клетках изученных микроорганизмов, что в конечном итоге приводит к формированию в D2O крупных атипичных клеток, состоящих из плотно упакованных мембран, наподобие мезосом, имеющих в 2-3 раза более толстую клеточную стенку; чем протонированные клетки с неравномерным распределением ДНК [8].
Полученные данные, в целом, подтверждают устойчивое представление о том, что адаптация к D2О является фенотипическим явлением, поскольку адаптированные к D2O клетки возвращаются после их переноса на обычную водную среду к нормальному росту после некоторого лаг-периода. В то же время эффект обратимости роста на H2O/D2O-средах не исключает возможности того, что определенный генотип детерминирует проявление одного и того же фенотипического признака в средах различного изотопного состава.
Биологические эксперименты с D2O дают возможность лучше прогнозировать условия, при которых зародилась жизнь. Трудно допустить, что жизнь могла возникнуть в «хаотической» неинформационной воде [9]. Живые организмы и вода являются сложными, самоорганизующимися системами с характерной структурой. Самыми благоприятными для зарождения жизни признаны минеральные воды и воды карстовых источников, взаимодействующие с СаСО3, а затем морские воды [10]. Циркулируя в полостях, микротрещинах и каналах, воды карстовых источников обогащаются Са(HCO3)2, активно взаимодействующим с органическим веществом и могут содержать информацию о жизни в более поздние геологические периоды. При этом самоорганизация первичных органических соединений в водной среде поддерживалась термальной энергией магмы, вулканической деятельностью и солнечной активностью.
Экспериментальные данные подтвержают, что жизнь возникла в горячей минеральной воде с повышенным содержанием дейтерия. Это также может служить подтверждением возможного пути перехода от синтеза малых органических молекул за счет энергии ультрафиолетового излучения Солнца к более сложным органическим молекулам протеинов и нуклеиновых кислот. Молекулы протеинов построены из одной или нескольких полипептидных цепей, состоящие из большого числа различных аминокислот. Их последующая конденсация в полипептидные цепи может произойти в определённых условиях, после их образования. Важным фактором в реакции конденсации двух молекул аминокислот является выделение Н2О. Поскольку реакция поликонденсации аминокислот сопровождается дегидратацией, при удалении Н2О из системы скорость реакции увеличивается. Этот факт свидетельствует о том, что раннее развитие жизни происходило вблизи действующих вулканов, поскольку в ранние периоды геологической истории вулканическая деятельность происходила более активно, чем в последующие геологические времена. Дегидратация сопровождает не только полимеризацию аминокислот, но и объединение других блоков в более крупные органические молекулы, а также полимеризацию нуклеотидов в нуклеиновой кислоты. Такое объединение всегда связано с реакцией конденсации, при которой от одного блока "отщепляется" протон Н+, а от другого - гидроксильная группа ОН- с образованием молекулы Н2О.
Впервые возможность существования реакций конденсации-дегидратации в условиях первичной гидросферы под воздействием синильной кислоты (HCN) и ее произодных - цианамида (HNCN2) и дицианамида HN(CN)2, доказал Кальвин в 1965 году [11]. HCN, HNCN2 и HN(CN)2 обладают дегидратирующей способностью и способностью катализировать процесс связывания молекулы Н2О первичной гидросферы [12]. На присутствие HCN в первичной гидросфере указывают и ранние эксперименты Миллера. В присутствии HCN и цианамидов конденсация отдельных блоков, сопровождаемая дегидратацией, происходит при нормальных температурах в сильно разбавленных водных растворах (рис. 2). Ракции поликонденсации аминокислот в присутствии HCN и ее производных зависят от кислотности водных растворов, в которых они протекают [13]. В кислых водных средах (рН 4-6) эти реакции не идут, тогда как щелочные условия (рН 8-9) способствуют их протеканию. В настоящее время не существует однозначного мнения, имел ли первичный океан щелочной состав, но вероятно, что именно таким значением рН обладала озерная и карстовая вода, соприкасавшаяся с базальтом, и эти реакции могли происходить при контакте воды с базальтовыми породами.
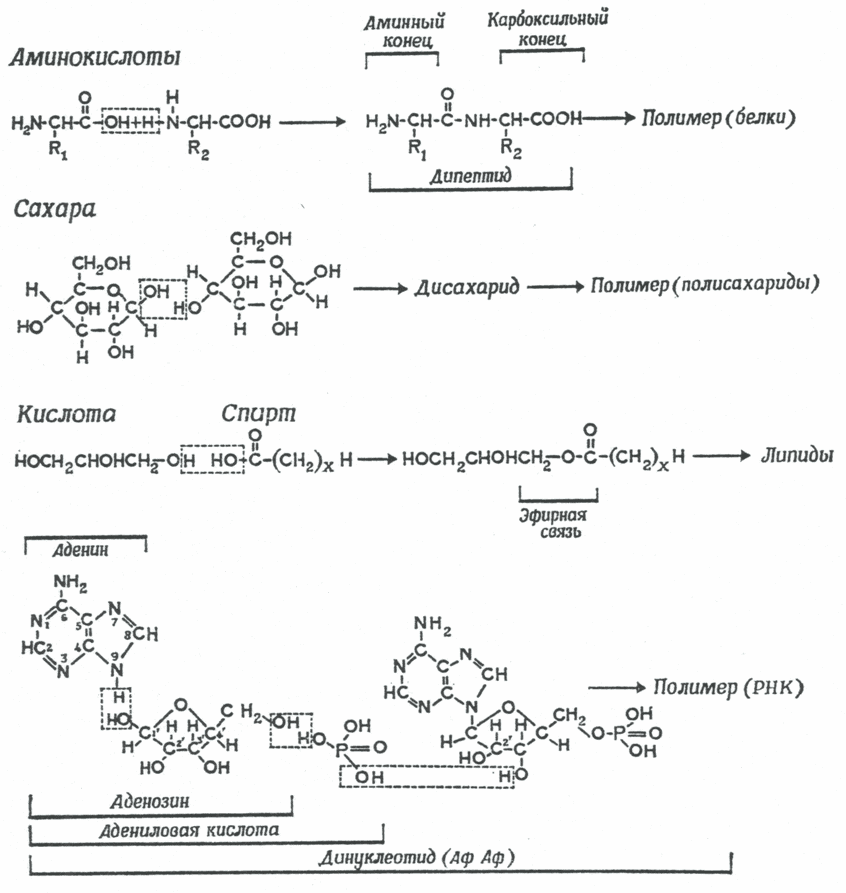
Рис. 2. Реакции конденсации и дегидратации, катализируемые HCN и ее производными, приводящие к образованию из отдельных молекул более крупных органических молекул. Верхние три уравнения: конденсация и последующая полимеризация аминокислот в протеины, углеводов в полисахариды и кислот и спиртов в липиды. Нижнее уравнение - конденсация аденина с рибозой и Н3РО3, приводящая к образованию нуклеотида [11].
В синтезе органических молекул могли использовались другие источники энергии, в т.ч. геотермальные. Так, в растворах формальдегида с гидроксиламином, формальдегида с гидразином и в водных растворах, содержащих НCN, после нагрева реакционной смеси до 95 0С в конце опыта обнаруживались аминокислоты [14]. В других экспериментах продукты реакции полимеризовались в пептидные цепи, что является важным этапом на пути к неорганическому синтезу белка. В реакционной смеси с раствором HCN в водном NH3 также образовывались более сложные соединения, входящие в состав нуклеиновых кислот – азотистые основания пурины и пиримидины (рис. 3) [15].
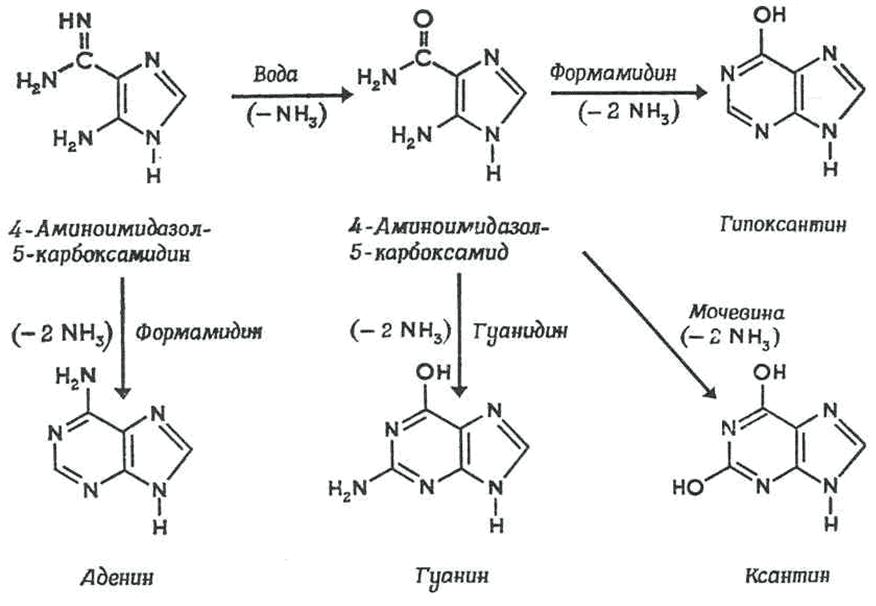
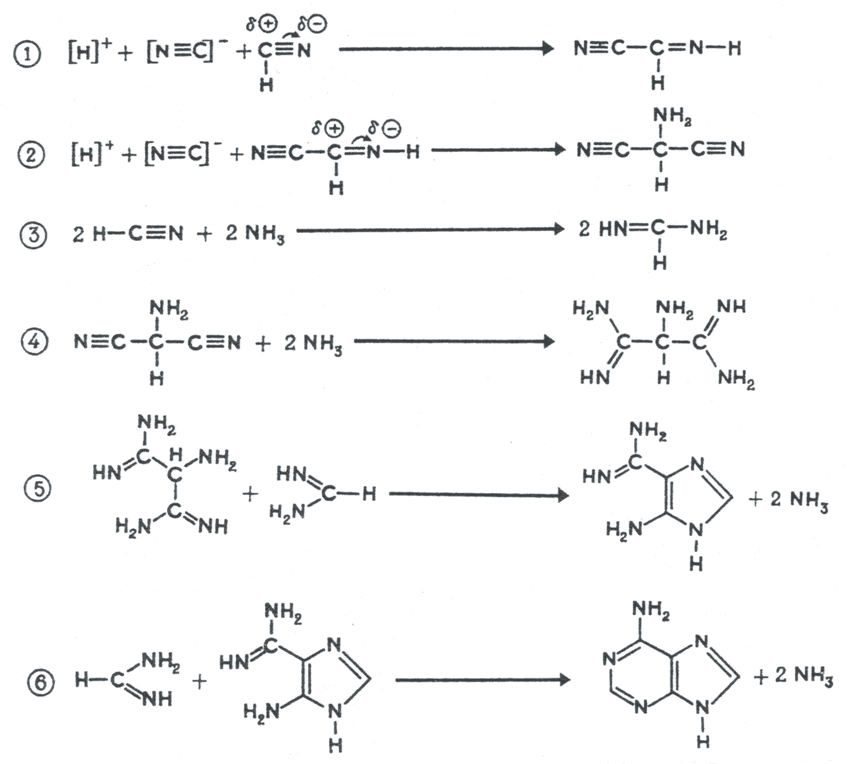
Рис. 3. Предполагаемые механизмы образования пуринов – аденина, гуанина и ксантина из водной смеси NH3 и HCN (вверху) и аденина из водной смеси NH3-HCN (внизу) при +95 0С. (суммарная реакция: 5HCN = аденин) [15]. Промежуточные продукты синтеза – 4-аминоимидазол-5-карбоксамидин и 4-аминоимидазол-5-карбоксамин детектировались в растворе.
В модельных условиях первичной гидросферы безводную смесь аминокислот подвергали воздействию температур от +600С до +1700С с образованием коротких белковоподобных соединений, обозначаемых термическими протеиноидами. Наилучшие результаты по поликонденсации получались со смесями аминокислот, содержащими аспарагиновую и глутаминовую кислоты, относящиеся к числу незаменимых аминокислот, встречающихся во всех современных организмах. Термические протеиноиды состоят из крупных молекул с молекулярной массой до 300000, состоящих из тех же аминокислот, что и природные белки. По количественному составу они содержат 18 из 22 аминокислот, обычно встречающихся у современных организмов, что сооответствует общему определению белка [16]. С природным белком протеиноиды сходны и по ряду других важных свойств: по связыванию полинуклеотидов, по пригодности в пищу бактериям и крысам, по способности вызывать реакции, сходные с теми, которые катализируются ферментами в живых организмах. Cинтетические протеиноиды способны каталитически разщеплять глюкозу [17] и оказывать действие аналогичное действию меланоцитстимулирующего гормона [18]. Другим важным свойством протеиноиноидов является их гетерогенность: т. е. последовательность аминокислот в их пептидных цепях не случайна, а, напротив, закономерна. При промывке горячей смеси протеиноидов водой или водными растворами солей, в водной среде образуются элементарные мембраноподобные микросферы с диаметром 5-10 мкм. [19]. По морфологическим особенностям микросферы напоминают мембрану клетки, которая может быть двойной (рис. 4).
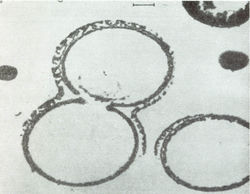
Образование протеноидных микросфер из смеси искусственных протеинов важно поскольку дает материал о следующем этапе эволюции жизни. Это этап от разрозненных органических молекул к группам организованных молекул - коорцерватам, собранным в отдельные структуры и отделенными от окружающего мира примитивной мембраной – аналогом мембраны клетки, что было впервые продемонстрировано выдающимся Российским ученым академиком А. И. Опариным [20].
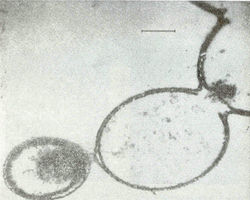
Рис. 4. Электронные микрофотографии протеноидных микросфер в водной среде [19].С учётом вышеназванных факторов происхождение жизни выглядит следующим образом. Начальным этапом эволюции, по-видимому, было образование в первичной гидросфере и насышенной водяными парами атмосфере при высоких температурах аминокислот и азотистых соединений – аналогов нуклеиновых кислот. Такой синтез возможен в условиях восстановительной атмосферы при наличии в водной среде H3PO3 и воздействии электрических разрядов, ультрафиолетового излучения и высоких температур [21]. Следующим этапом является поликонденсация аминокислот в термические протеиноиды при температурах 65-1700С в присутствии H3PO3 и фосфатов при наличии в водной смеси достаточных количеств аспарагиновой и глутаминовой кислот. Затем в смеси термических протеиноидов при воздействии на них водой или кислыми водными растворами (дождем) образуются протеиноидные микросферы – предшественники первых клеток, обладающие каталитической активностью. Способность термических протеиноидов к выполнению некоторых функций, сходных с функциями ферментов живых организмов, выражается в том, что они способны в присутствии катионов Zn2+ расщеплять АТФ, т. е. обладают слабой ферментативной активностью. Впоследствие у микросфер могла появиться способность к синтезу РНК, которые могли случайным образом кодировать короткие белки. Подтверждением того, что жизнь образовалась в горячей воде служат недавние исследования Т. Сугававы, который воздействуя на водную смесь органических молекул, ДНК и протеинов при +95 0С получил т.н. протоклетки, обладающие элементарной мембраной.
Много важной информации о ранних этапах эволюции несут падающие на Землю метеориты и кометы Метеориты – обломки давно существующих планет, определяющие их состав и движущиеся подобно малым планетам эллиптическим орбитам. По составу метеориты делятся на железные, каменные, железо-каменные и углистые с содержанием углерода от 3-7%. Наиболее распространёнными химическими элементами в метеоритах являются: Al, Fe, Ca, O, Si, Mg, Ni, S. Химический состав отдельных метеоритов может значительно отклоняться от среднего. Так, например, содержание Ni в железных метеоритах колеблется от 5% до 30%. Среднее содержание в метеоритах драгоценных металлов и редких элементов (в г на 1 т вещества метеорита): Ru, Rh, Pd, Ag, Os, Pt, Au. Установлено, что содержание некоторых химических элементов в метеоритах связано с содержанием других элементов: чем выше содержание Ni в метеоритах, тем меньше в нём Ga, и т.п. Изотопный состав многих химических элементов элементов в метеоритах тождественный изотопному составу тех же элементов земного происхождения. Наличие в метеоритах радиоактивных химических элементов и продуктов их распада позволило определить возраст вещества, составляющего метеориты, который оказался равным 4,5 млрд. лет. В межпланетном пространстве метеориты подвергаются воздействию космических лучей, и в них образуются стабильные и нестабильные космогенные изотопы. По их содержанию определён космический возраст метеоритов, т. е. время их самостоятельного существования, составляющее для разных экземпляров от немногих миллионов до сотен миллионов лет.
В составе метеоритов также обнаружен ряд неизвестных или очень редко встречающихся на Земле минералов таких как шрейберзит, добреелит, ольдгамит, лавренсит, меррилит и др., которые присутствуют в метеоритах в незначительных количествах. За последние годы в метеоритах открыто несколько десятков новых, ранее неизвестных минералов, многие из которых названы по имени метеоритологов, например: фаррингтонит, юриит, найнинджерит, криновит и др. Наличие этих минералов указывает на своеобразие условий образования метеоритов, отличающихся от условий, при которых образовались земные горные породы. Наиболее распространёнными в метеоритах минералами являются: никелевое железо оливин, пироксены - безводные силикаты (энстатит, бронзит, гиперстен, диопсид, авгит) и иногда плагиоклаз.
Некоторые специфические метеоритные минералы, например лавренсит, очень нестойки в условиях Земли и быстро вступают в соединения с кислородом воздуха. В результате на метеоритах появляются продукты окисления в виде ржавых пятен. В некоторых редких типах метеоритов присутствует кристаллическая космическая вода (до 20%), а в других, столь же редких метеоритах встречаются мелкие зёрна алмаза. Кроме этого, в метеоритах были выделены разные газы, встречающиеся в разных количественных соотношениях, органические соединения – углеводороды, азотистые соединения, карбоновые и жирные кислоты, азотистые соединения, аминокислоты и др.
Самый известный метеорит – „Мерчисон”, упал в Австралии в 1969 году близ города Мерчинсон. Этот необычный метеорит – носитель неземных органических соединений, состоял из углистого хондрита. При исследовании в нем были обнаружены 18 аминокислот неземного происхождения.
В других углистых метеоритах (Orgueil, Mighei) обнаружены минерализированные «организованные элементы» — микроскопические (5-50 мкм) «одноклеточные» образования, имеющие явно выраженные двойные стенки (рис. 5 и рис. 6). Характерной особенностью этих образований является также их многочисленность: на 1 грамм вещества углистого метеорита приходится примерно 1800 «организованных элементов». Ничего определённого о происхождении этих элементов в метеоритах, имеющих много общих черт с одноклеточными организмами, пока сказать нельзя. Организованные элементы были исследованы методом сканирующей электронной микроскопии с помощью микрозонда, в результате было обнаружено, что эти структуры минерализованы соединениями железа, никеля, хлора и некоторыми другими элементами, что свидетельствует о том, что формирование этих соединений происходило в водной, среде в условиях низких температур.
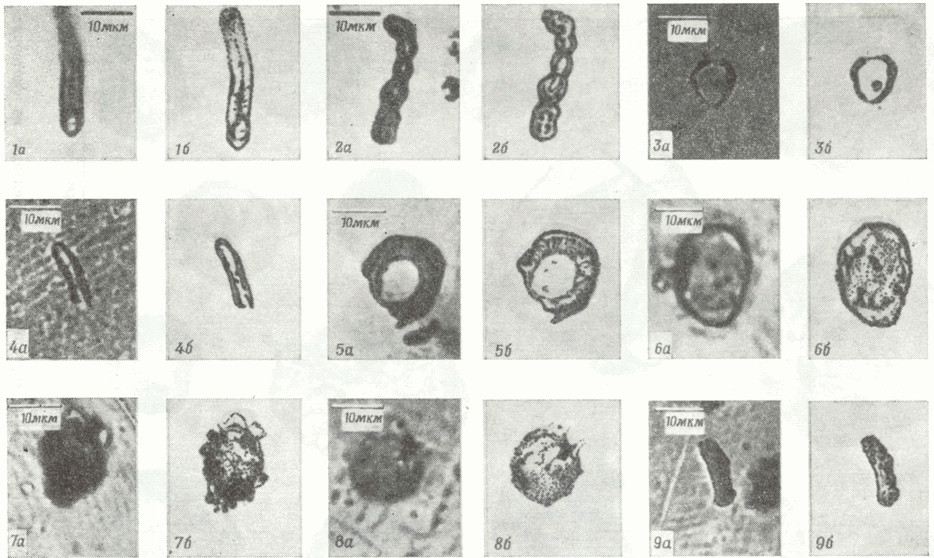
Рис. 5. Микрофотографии “организованных элементов ” из метеорита Orgueil [22]. С помощью сканирования электронным зондом показано, что образования 1, 2, 3, 4, 5 и 9 частично минерализованы железом с примесями хлора. В образовании 6 обнаружены железо и никель, а образцы 7 и 8 состоят из силиката магния.

Рис. 6. Микрофотографии “организованных элементов ” из метеорита Mighei [22].Еще в прошлом веке ученые, подвергая химическому анализу углистые хондриты, пытались найти в них воду, без которой невозможна жизнь. Однако прошло не одно десятилетие, прежде чем эти поиски увенчались успехом. В 1944 году академик А. Заварицкий обнаружил в найденном в 1930 году в Оренбурской области метеорите "Старое Борискино" "космическую" воду. Впоследствии следы воды находили и в ряде других углистых метеоритов. Содержание воды в них достигает до 20 мас.%.
По мнению некоторых исследователей, другими носителями органических соединений, от которых произошла земная жизнь, могли быть и кометы и их газовые "хвосты", состоящие из кристаллов льда и частиц космической пыли. Они образуют оболочку кометы, а с приближением её к Солнцу часть из них — под давлением солнечных лучей и солнечного ветра — переходит в хвост. Ядро кометы сформировано из обычного льда с небольшими включениями углекислых и метановых льдов, а также частичек пыли. Земля, обращаясь вокруг Солнца, за всю историю много раз пересекала "хвосты" многих комет. Когда комета сближается с Солнцем, происходит частичное испарение внешних слоев ледяного ядра. В результате этого, внешние слои ледяного ядра испаряются, благодаря чему вокруг него образуется водяное облако из кристаллов льда и частичек пыли, которое становится "хвостом" кометы, в котором могут находиться органические молекулы. Так, в 2005 году в комете Темпел была обнаружена аминокислота глицин – основная составляющая природных молекул протеинов.
Последние научные данные доказывают, что „кирпичики” жизни – органические молекулы существовали еще до зарождения Солнечной системы и планеты Земля. На нашей планете органические молекулы из метеоритов могли попасть в водную среду для их последующей эволюции в ранние формы жизни. За последние десятилетия, используя самые разные виды энергии, в лабораторных условиях были получены самые разнообразные органические соединения – аминокислоты, короткие протеины, азотистые основания, нуклеозиды, нуклеотиды и др. В этих опытах моделировались условия первичной бескислородной атмосферы. Было установлено, что первичной бескислородной атмосфере древней Земли был возможен синтез органических молекул за счет энергии коротковолнового ультрафиолетового излучения Солнца, энергии электрических разрядов и за счет других геотермальных источников энергии, как вулканы.
Важную роль в происхождении жизни, по-видимому, играл самый распространённый минерал земной коры кварц (SiO2). Кристалл кварца обладает тетраэдрической структурой, из которой могут складываются различные цепочечные и ленточные силикатные структуры (рис. 7). Уникальность кварца заключается в том, что его кристаллы оптически активны, т. е. способны взаимодействовать с поляризованным светом, в т.ч на поверхности кристалла. Поэтому, на поверхности L- и D- энантиомерных кристаллов кварцев была возможна избирательная абсорбция L- и D-изомеров, что может объяснить стереоселективность эволюции.
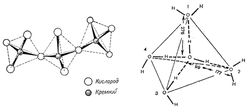
Рис. 7. Кристаллическая структура кварца (слева) и тетраэдрическая структура воды (справа).Предполагаемая структура воды могла быть обусловлена ее древней реологической связью с кварцем и другими кремнекислородными минералами, преобладающими в земной коре, в контакте с которыми пребывала вода. С кальциево-силикатными породами связано и развитие древнейших форм жизни на Земле. Самые древние доказательства существования живых организмов со слоистой известковой структурой на Земле датируются 3,5 миллиардами лет. Эти древнейшие известковые (доломитовые) ископаемые докембрийского периода – строматолиты строили свой скелет из известняка и диоксида кремния SiO2. Строматолиты формировались на дне неглубоких водоемов в архее в самую древнюю геологическую эпоху Земли — 2,5−3,5 млрд лет назад. Изучение этих образований очень важно, так как строматолиты хранят сведения о зарождающейся жизни на Земле и органическом составе первых живых организмов – многочисленных колоний цианобактерий, диатомовых водорослей и нефтеперерерабатывающих бактерий, возникающих в толщах известняков и доломитов в жерлах погасших вулканов и термических источников. Эти планктонные формы обитают в верхних слоях морской воды вместе с другими организмами, обладающими известковыми (фораминиферы) и хитиновыми скелетами размер которых достигает несколько десятков микрометров. После смерти эти организмы опускались на морское дно; вещество их скелета химически взаимодействовало с морской водой. Карбонат кальция фораминифер и хитин других планктонных микроорганизмов растворялись в воде лучше, чем кремнезём диатомовых водорослей и радиолярий, формируя осадки кремнезёма. Кремнистые сланцы с отложениями этих кремнийсодержащих микроорганизмов формировались в эпоху фанерозоя в глубоких океанских впадинах, на глубинах около 1-2 км. Временный расцвет организмом с кренезёмным скелетом мог привести к такому скоплению кремния в водах океана. Затем SiO2 могла кристаллизоваться вокруг рассеянных в известняке центров кристаллизации, постепенно замещая молекулы CaCO3. Позднее, организмы, обладающие известковыми панцирями - фораминиферы стали абсорбировать Ca2+ из известняковых пород.
При рассмотрении природных процессов самоорганизации существует интересный феномен, найденный в карстовых источниках местечка Zlatna Panega, Teteven (Болгария). Обитающие там сине-зеленые водоросли окружены пузырьками диаметром 3-5 мм, время жизни которых составляет от нескольких часов до дней. Вода, ИК-спектр которой аналогичен ИК-спектру сока растений, имеет тенденцию сохранять самоорганизацирующие структуры. При добавлении к раствору пектинов катионов Ca2, раствор принимает желатинизорованную структуру, поскольку катионы Ca2+ обладают способностью связывания с молекулами пектина с формированием комплексов. Очевидно, эти комплексы играют существенную роль в объединении различных компонентов клеточной мембраны и влияют на ее компактность и прочность.
Полученные данные указывают на то, что зарождение жизни зависит, как от качества и структуры воды, так и от дополнительных условий. Ближе всего к этим условиям является минеральная вода, взаимодействующая с CaCO3. По качественным показателям за ней следуют морская и горная вода.
В этой связи важны следующие реакции:
(1) CO2 + 4H2S + O2 = CH2O + 4S + 3H2O
(2) СаСО3+ HOH + СО2 = Ca(HCО3)2
(3) CO2 + ОН- = HCО3-
(4) 2HCO3- + Ca2+ = CaCO3 + CO2 + H2O
Уравнение (1) показывает, что некоторые хемосинтетические бактерии используют энергию, полученную в результате окисления H2S до S.
Уравнение (2) связано с одним из самых распространëнных процессов в природе – переход CaCO3 в Ca(HCО3)2 в присутствии Н2О и СО2. При наличии ОН- ионов СО2 превращается в HCО3- (уравнение 3). Уравнение (4) показывает процессы, сопровождающие формирование строматолитов.
В Черном море наблюдается интересный феномен. На глубинах в воде присутствует сероуглерод (H2S), концентрации которого настолько высоки, что ниже 120-200 метров в Чёрном море жизни почти нет. Причиной наличия таких высоких концентраций сероводорода в водах Черного моря является деятельность особых бактерий Bacterium hydrosuifureurn Penticum, Vibro sulfureus и Microspira aestuaria, способных выделять сероводород при восстановлении сульфатов, солей, растворенных в морской воде. Как следует из приведенных выше уравнений, в начале эволюции некоторые хемосинтетические бактерии использовали также энергию, полученную в результате окисления сероводорода (H2S) до серы (S). В разные геологические эпохи сероводородные зоны занимали различную площадь. Около 3,5 — 3,7 миллиарда лет назад (самый ранний докембрий), когда атмосфера Земли содержала крайне мало кислорода, причем небиологического происхождения (образовывавшегося, например, при остывании базальтовой магмы, по гипотезе геохимика В.И. Вгатова), воды океана были полностью сероводородными. И первая жизнь в океане также была анаэробной. Первые живые простейшие, вероятно, мало отличались от современных нам анаэробных бактерий. Даже при отсутствии или малом количестве органического вещества, как это было в первичном океане, анаэробные бактерии могли выделять сероводород. Потом, по мере того как состав атмосферы изменялся, в ней скапливался кислород, сероводородные зоны уменьшались. Этот процесс продолжался сотни миллионов лет. Вероятно, вода Черного моря “сохранила” память о первичном океане.
Биогенное происхождение имеет также и кислород атмосферы Земли, который образовался за счет процесса фотосинтеза зелеными растениями. Жизнь на Земле, как подтверждают данные палеогеологии, возникла в докембрийскую эпоху. Так, в научной литературе сообщалось о находках ископаемых водорослей в Южной Африке, возраст которых 2,7 млрд. лет. Обнаружены также остатки органического происхождения в южноафриканской формации Фиг-Три, возраст которой приблизительно 3,5 млрд. лет. Академик Б.С. Соколов на основе имеющихся сведений о развитии жизни на нашей планете в раннем докембрии сделал вывод, что биогенные накопления кислорода в океане начались 3,0 — 3,5 млрд. лет назад, а в атмосфере - 2 млрд. лет тому назад.
По мере того как характер земной атмосферы в процессе эволюции изменился с восстановительного на окислительный, условия жизни на Земле изменились, что способствовало очистке гидросферы от дейтерия. По мнению О.В. Мосина, в те времена существовало два очень важных процесса. В первичной атмосфере Земли не было защитного кислородно-озонового слоя, защищающего поверхность Земли от жёсткого коротковолнового излучения Солнца. Поэтому, вследствие вулканических геотермальных и электрических процессов могло происходить обогащение гидросферы Земли дейтерием. Кроме того под действием излучения мог происходить радиолиз и фотолиз воды.
На более позднем этапе вода могла очищаться от дейтерия при помощи горных пород. Определенную роль в этом процессе, по-видимому, играли карстовые породы. В настоящее время содержание дейтерия в карстовых источниках равняется 30-35 г/тонна. В морской воде его содержание 150-200 г/тонна. Очевидно, что когда в воде меньше дейтерия, эволюция происходит быстрее. Если на Земле не начался естественный процесс очистки от дейтерия, эволюция могла остаться на низком уровне.
В 2010 г. центре исследования медицинской биофизики Болгарии были исследованы образцы "деионизированной" воды (контроль), минеральной воды, морской воды, воды из карстовых источников и горной воды из Болгарии с использованием устройства Антонова для спектрального ИК-анализа воды. Также были исследованы образцы минеральных вод из различных болгарских источников. В качестве модельной системы использовался сок кактуса, поскольку это растение содержит приблизительно 90 H2O. Полученные данные продемонстрировали, что наиболее близкий к ИК-спектру контрольной воды являлся ИК-спектр минеральной воды, контактирующей с СаСО3. Карстовые воды имеют подобный ИК-спектр. Наиболее близкий к ИК-спектру сока имел ИК-спектр карстовых вод, взаимодействующих с минеральной водой. Так, ИК-спектры сока растений, минеральная вода и вода карстовых источников, взаимодействующих с CaCO3, имели значения пиков ИК-спектров при -0,1112; -0,1187; -0,1262; -0,1287 и -0,1387 еV, соответственно. 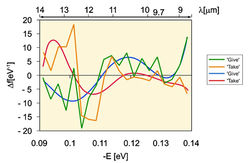
Рис. 8. Дифференциально-неравновесный энергетический спектр (ДНЭС-спектр) воды в различных экспериментальных условиях (∆EH...O = -0.1067±0.0011 eV; локальные максимумы при λ = 8,9-12,8 μм).Подобные пики в ИК-спектре между соком растений, горной и морской водой детектировались при -0,1362 еV. ИК-спектр контрольного образца деионизированной воды существенно отличался от ИК-спектра питьевой, минеральной и горной воды. Также были измерены величины средней энергии (∆EH...O) водородных Н…О-связей между молекулами H2O в процессе формирования кластерных ассоциатов формулы (H2O)n, составляющие -0.1067±0.0011 eV. Физическими методами исследований доказано значение ∆EH...O = -0,0984 eV, и оно совпадает с одним из пиков в ДЭНС-спектре воды (рис. 8). При изменении температуры воды изменяется средняя энергия водородных H...O связей в ассоциатах молекул H2O [23]. Проведенный спектральный анализ воды при различных био-физических взаимодействиях показал процесс самоорганизации молекул воды в результате поляризации водных кластеров, что видно из ДЭНС-спектра воды в различных экспериментальных условиях (рис. 8).
Заключение
Полученные экспериментальные данные свидетельствуют о том, что возникновение жизни зависит как от структуры и свойств воды, так и от внешних факторов – температуры и значения рН. Данным условиям наиболее лучше удовлетворяет взаимодействующая с CaCO3 минеральная вода. Затем по качеству следует горная вода [24]. В теплых и горячих минеральных водах ИК-пики в неравновесном энергетическом ИК-спектре (DNES) более выражены по сравнению с ИК-пиками, полученными в той же воде с более низкой температурой. Это показывает на большую энергию для сохранения самоорганизованных структур во времени. Спектральный диапазон DNES-спектра воды находится в среднем ИК-диапазоне от 8 до 13 микрометров. Предполагается, что существует “окно прозрачности” земной атмосферы для электромагнитной радиации в среднем ИК-диапазоне. В этом интервале энергия излучается от Солнца к Земле, и от Земли в окружающее пространство. Вода также может изменять свою структуру и физико-химические свойства с космическими ритмами. Вероятность происхождения жизни является наиболее большой в теплой и горячей воде с определенной структурой и составом. В январе 2010 г. Д. Вард описал ископаемые строматолиты Йеллоустонского национального парка США. Были изучены микроорганизмы, формирующие строматолиты в горячей воде подобно древним организмам в зонах вулканической активности, нагреваемых магмой. Этот факт является подтверждением нашей гипотезы, основанной на биофизических исследованиях происхождения жизни в теплых и горячих минеральных водах и гейзерах с повышенным содержанием дейтерия. В июне 2010 г., сообщение на данную тему было опубликовано авторами на конгрессе Euromedica в Ганновере (Германии). В сентябре 2010 г., американские ученые Стокбриддж, Льюис, Yung Юань и Wolfenden опубликовали статью “Воникла ли жизнь в горячей воде?”, в которой они рассмотрели вероятность протекания более быстрых биохимических реакций в горячей воде. Однако, ничего не было сказано о изотопнойм составе воды и возможном наличии в ней дейтерия. Если на начальных этапах эволюции первичная вода действительно содержала больше дейтерия как считает российский исследователь воды О.В. Мосин, то это является существенным фактом относительно термоустойчивости и стабильности дейтерированных макромолекул в поддержании жизни в условиях повышенных температур, поскольку химические связи, образованные с участием дейтерия прочнее таковых, образовынных с участием водорода.
Литература
1. Linsky, J.L. D/H and nearby interstellar cloud structures, Space Science Reviews, NY: Springer Science, Business Media (2007), 130, p. 367; Linsky, J.L. et al. “What is the total deuterium abundance in the local Galactic disk?”, Astrophysical Journal, 647, 1106 (2007).
2. Lis G., Wassenaar L.I., Hendry M.J. “High-Precision Laser Spectroscopy D/H and 18O/16O Measurements of Microliter Natural Water Samples”, Anal. Chem., 80(1), 287-293 (2008).
3. Мосин О.В. “Дейтерий, тяжелая вода, эволюция и жизнь”, Водоочистка, водоподготовка, водоснабжение, 8, 64-70 (2009).
4. Лобышев В.Н, Калиниченко Л.П. Изотопные эффекты D2O в биологических системах. Москва.: Наука (1978), 215 с.
5. Мосин О.В, Складнев Д.А., Швец В.И. “Исследование физиологической адаптации бактерий на тяжёловодородной среде”, Биотехнология, 8, 16-23 (1999).
6. Vertes A. Physiological effects of heavy water. Elements and isotopes: formation, transformation, distribution, Dordrecht: Kluwer Acad. Publ. (2004), 112 p.
7. Мосин О.В, Складнев Д.А., Швец В.И. “Методы получения белков и аминокислот, меченных стабильными изотопами 2Н, 13С и 15N”, Биотехнология, 3, 12-32 (1996).
8. Мосин О.В., Игнатов И. “Изотопные эффекты дейтерия в клетках бактерий и микроводорослей”, Вода: химия и экология, 3, 83-94 (2012).
9. Игнатов И. В кн: Биоэнергетическая медицина. Зарождение живой материи, “память воды”, биорезонанс, биофизические поля, София: ГеяЛибрис (2006), 93 c.
10. Мосин О. В., Игнатов И. “Структура воды и физическая реальность”, Сознание и физическая реальность”, 10(6), 16-32 (2011).
11. Кальвин M. Химическая эволюция, Мир, Москва (1971), с. 48-50.
12. Mathews C.N., Moser R. “Peptide synthesis from hydrogen-cyanide and water”, Nature, 215, 1230-1234 (1968).
13. Abelson P. “Chemical events on the"primitive earth”, Proc. Natl. Acad. Sci. U. S., 55, 1365-1372 (1966).
14. Harada I., Fox S.W. “Thermal synthesis of natural ammo-acids from a postulated primitive terrestrial atmosphere”, Nature, 201, 335-336 (1964).
15. J. Оrо. Prebiological organic systems, in: S. W. Fox (ed.), The Origin of Prebiological Systems, NY: Academic Press (1965), p. 137-162.
16. Fox S. W., Harada K., Woods K.R., Windsor Ch.R. “Amino Acid compositions of proteinoids”, Archives of Biochemistry and Biophysics, 102(3), 439-445 (1963).
17. Fox S.W., Krampitz G. “Catalytic decomposition of glucose in aqueous solution by thermal proteinoids”, Nature, 203, 1362-1364 (1964).
18. Fox C.W., Wang C.T. “Melanocytestimulating hormone: Activity in thermal polymers of alpha-ammo acids”, Science, 160, 547-548 (1968).
19. Nakashima T. Metabolism of proteinoid microspheres. In: Origins of Life and Evolution of Biospheres (1987), 20 (3-4), p. 269-277.
20. Опарин А.И. Пути начально формирования обмена веществ и искусственное моделирование этого формирования в коацерватных каплях. В кн: С. Фокс (ред.), Происхождение предбиологических систем, М: Мир (1966), 137 с.
21. О.В. Мосин, И.Игнатов. “Осознание воды как субстанции жизни”, Сознание и физическая реальность, 16(12), 9-20 (2011).
22. Rutten M. G. The Origin of life by natural causes, Elsevier Publishich Comp., N. Y. (1971), p. 89-91.
23. Ignatov, I., Tsvetkova, V. Water for the origin of life and informationaability of water, Kirlian (electric images) of different types of water, EUROMEDICA, Hanover (2011).
24. Ignatov, I., Which water is optimal for the origin (generation) of life? EUROMEDICA, Hanover (2010).