Характеристика на кандидата химических наук О.В.Мосина
Министерство образования РФ, Московская Государственная Академия тонкой химической технологии.
Министерство образования РФ, Московская Государственная Академия тонкой химической технологии.
Отзыв о диссертации О.В.Мосина.
Профессор А.М.Юркевич.


1). Ферментационная среда (FM-среда), приготовленная стандартно на обычной воде.
2). Ферментационная среда, приготовленная из 99,9 ат.% 2Н2O (dFM-среда) и содержащяя дейтерий-меченную биомассу метилотрофных бактерий, выделенную, соответственно из среды dМ9.

2006 г. О. В. МОСИН
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571.
Изучена возможность биосинтетического получения дейтерий-меченного инозина путём выделения из культуральной жидкости штаммапродуцента Bacillus subtillis. Метод получения инозина основан на использовании в качестве источника ростовых факторов при культивировании штамма-продуцента гидролизатов дейтерированной биомассы факультативных метилотрофных бактерий Brevibacterium methylicum, полученных со среды, содержащей 98 об.% 2Н2O и 2 об.% С2Н3О2Н. Приведены экспериментальные данные по росту штамма B. subtilis и биосинтезу инозина на среде, приготовленной из 99,9 ат.% 2Н2О и гидролизатов биомассы метилотрофных бактерий. Анализ степени дейтерированности инозина был проведён с использованием масс-спектрометрии FAB. Полученные результаты свидетельствуют о высокой степени включения дейтерия в инозин (62,5 % атомов водорода в углеродном скелете молекулы замещены на дейтерий).
В настоящей работе уровни включения дейтерия в молекулы аминокислот определяли методом масс-спектрометрии EI MS в виде метиловых эфиров N-Dns-производных аминокислот, за счет сопоставления молекулярных масс протонированных и 2Н-меченых производных аминокислот.
Полученные микробиологическим синтезом 2Н-меченые аминокислоты представляли собой смеси изотопнозамещённых форм молекул, различающихся количеством атомов водорода, замещённых на дейтерий. Вследствие этого эффекта пики молекулярных ионов метиловых эфиров N-Dns-аминокислот в масс-спектрах были полиморфно расщеплены на кластеры за счет примеси молекул с отношениями m/z, больше или меньше детектируемых прибором величин (М)+ с различным вкладом в суммарный уровень дейтерированности.
Во всех экспериментах не зависимо от присутствия 2Н2О в ростовой среде было зафиксировано увеличение продукции фенилаланина на ранней фазе экспоненциального роста, когда выход микробной биомассы был незначителен, в то время как на фазе позднего экспоненциального роста наблюдалось снижение уровня его накопления в ростовой среде.
Для того чтобы объяснить эффект снижения уровня накопления фенилаланина были высказаны возможные предположения о морфологической неоднородности микробной популяции, ингибировании биосинтеза фенилаланина конечным продуктом нарушении транспорта фенилаланина через клеточную мембрану. Результаты по микроскопическому исследованию растущей популяции микроорганизмов показали, что данный характер динамики накопления фенилаланина не коррелировал с качественными изменениями клеточной морфологии на поздних стадиях роста, что служило подтверждением морфологической однородности микробной популяции..
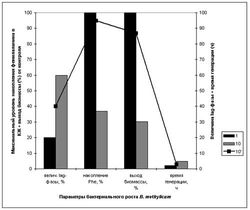
За ходом адаптации следили по изменениям продолжительности лаг-фазы, времени клеточной генерации и выходов микробной биомассы, а также по максимальному уровню накопления фенилаланина в ростовой среде (рис. 2). Так, выход микробной биомассы, время клеточной генерации и уровень накопления фенилаланина в ростовой среде при росте адаптированного к 2Н2О штамма в 98 об.% 2Н2О изменяются по сравнению с контрольными условиями на 13, .. и 5%, т. е. незначительно (рис. 2, опыт 5’). Продолжительность времени генерации существенно не отличается от исходного штамма на Н2О-среде. Адаптированные к 2Н2О клетки сохранили способность синтезировать и экзогенно продуцировать фенилаланин в ростовую среду, который можно выделять в количестве 0.95 г/л.
Для выращивания штамма был выбран ступенчато-увеличивающийся градиент концентрации 2H2О в ростовых средах в присутствии 2 об.% [U -2H] MetOH, так как предпологалось, что постепенное привыкание клетки к 2Н2О будет оказывать благоприятный эффект на параметры роста и общее самочувствие культуры (таблица). Для компенсации ауксотрофности по лейцину эту аминокислоту добавляли в ростовую среду в протонированном виде в концентрации 10 мг/л.
Сначала исходный штамм выращивали на 2Н2О-содержащих средах без его предварительной адаптации к 2Н2О, для того чтобы определить его ростовые и биосинтетические параметры на этих средах.
БИОТЕХНОЛОГИЯ
О. В. МОСИН
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571, Москва, просп. Вернадского, 86.
Разработан метод физиологической адаптации нового фенилаланин-продуцирующего RuMP штамма факультативных метилотрофных бактерий Brevibacterium methylicum к максимальным (98 об.%) концентрациям 2Н2О с целью последующего микробиологического синтеза 2Н-меченого фенилаланина. Метод заключается в последовательом рассеве штамма на агаризованных средах М9 с 2 об.% [U -2Н]MetOH со ступенчато возрастающим градиентом концентрации 2Н2O (от 0 до 98 об.% 2Н2О) и последующей селекцией колоний по признаку устойчивости к 2Н2О. В результате применения разработанного подхода для данного штамма метилотрофных бактерий на среде с 98 об.% 2H2О были отобраны отдельные колонии, сохранившие высокие ростовые и биосинтетические параметры.
В ходе выполнения работы было проведено препаративное разделение аминокислот культуральной жидкости и гидролизатов биомассы метилотрофных бактерий методами обращенно-фазовой ВЭЖХ в виде бензилоксикарбонильных производных аминокислот. Так, дейтерий-меченный фенилаланин был выделен из культуральной жидкости В. methylicum методом обращённо-фазовой ВЭЖХ в виде Z-производного с хроматографической чистотой 99% и выходом 89%.
Хроматографически чистые 2Н-и 13С-аминокислоты были выделены из гидролизатов биомассы B. methylicum и M. flagellatum в виде их Z-производных в миллиграммовых количествах [8]. Отдельные аминокислоты: фенилаланин и лейцин были также хроматографически выделены из культуральных жидкостей данных штаммов метилотрофных бактерий в виде метиловых эфиров дансил-аминокислот.
2Ни 13С-меченные аминокислоты в составе гидролизатов белка биомассы были получены в условиях, аналогичных таковым для секретируемых аминокислот (табл. 4). Хотя в таблице 4 приведены данные только для 10 аминокислот, не вызывает сомнения, что в остальных аминокислотах уровни изотопного включения сопоставимы, хотя они не детектируются данным методом. Это предположение подтверждается данными по разделению белковых гидролизатов метилотрофных бактерий методом ионнообменной хроматографии, где детектируется уже 16 аминокислот (см. рис. 3).
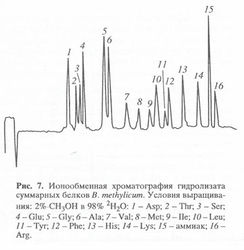
Эффективность использования дансильных и Z-производных аминокислот для масс-спектрометрических исследований была показана раннее [10, 16]. В данной работе уровни включения изотопов 2Н-и 13С в мультикомпонентные смеси аминокислот в составе культуральной жидкости и белковых гидролизатов определяли методом масс-спектрометрии электронного удара метиловых эфиров дансил-аминокислот или в виде Z-производных аминокислот после их препаративного разделения методом обращённо-фазовой ВЭЖХ.
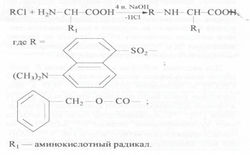
Для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с монопроизводными было характерно образование ди-Z-(Dns)-производных: ди-Z,(Dns)-лизина, ди-Z,(Dns)-гистидина, О,N-ди-Z,(Dns)-тирозина, O,N-ди-Z,(Dns)-серина, O,N-ди-Z,(Dns)-треонина и N,S-ди-Z,(Dns)-цистеина (на схеме 1 эти произодные не показаны). Кроме этого, из аргинина синтезировался три-Z,(Dns)-аргинин.
Данные по росту штамма М. flagellatum на минимальных средах, с 1 об.% СН3ОН (С2Н3О2Н/13СН3ОН) и содержащих ступенчато увеличивающиеся концентрации тяжёлой воды приведены в таблице 1. Как видно из таблицы 1, на средах, содержащих обычную воду и аналоги метанола С2Н3О2Н и 13СН3ОН выходы микробной биомассы составили 81% и 72% соответственно, а на средах с 74,5 об.% 2Н2О выход биомассы составил 29%, что в 3,4 раза ниже, чем в контрольных экспериментах, когда использовали простую воду и метанол (табл. 1, опыты 1, 3, 8). Как видно из таблицы 1, устойчивый рост у M. flagellatum сохранялся лишь в средах, содержащих меньше чем 74,5 об.% 2Н2О. Выше этой концентрации наблюдалось ингибирование роста.
Бактериальные штаммы. Исследования проводили с генетически маркированными штаммами метилотрофных бактерий, полученными из коллекции культур Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов:
1. - Brevibacterium methylicum ВКПМ В 5652, лейцинзависимый штамм факультативных метилотрофных бактерий, продуцент L-фенилаланина.
2. - Methylobacillus flagellatum KT, изолейцинзависимый штамм облигатных метилотрофных бактерий, продуцент L-лейцина.
В работе использовали 2Н2O (99,9% 2Н), С2Н3О2Н (97,5 % 2Н) и 13СН3ОН (97,5 % 13С), полученные из Российского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ), а также N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША), карбобензоксихлорид (Войковский химзавод, РФ).
БИОТЕХНОЛОГИЯ
МЕТИЛОТРОФНЫЕ БАКТЕРИИ - ИСТОЧНИКИ ИЗОТОПНО - МЕЧЕННЫХ 2Ни 13САМИНОКИСЛОТ.
О.В. МОСИН.
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571.
Изучена возможность использования различных штаммов метилотрофных бактерий для получения аминокислот, меченных стабильными изотопами 2Н и 13С, как секретируемыми в культуральную жидкость в процессе ферментации штаммов-продуцентов, так и выделяемыми из гидролизатов суммарного белка биомассы. Представлены данные по адаптации L-фенилаланин-продуцирующего штамма факультативных метилотрофных бактерий Brevibacterium methylicum к ростовым средам, содержащим 2 об.% С2Н3О2Н и 98 об.% 2Н2О и биосинтезу L-фенилаланина. Для L-лейцин-продуцирующего штамма облигатных метилотрофных бактерий Methylobacillus flagellatum проведено культивирование на среде, содержащей 1 об.% 13СН3ОН и 99 об.% Н2О. Уровни изотопного включения 2Ни 13С в аминокислоты были изучены методом масс-спектрометрии электронного удара в виде метиловых эфиров N-диметиламинонафталин-5-сульфонильных (дансильных) производных аминокислот и бензилоксикарбонильных производных (Z-производных) аминокислот. Максимальные уровни включения стабильных изотопов 2Н-и 13С в аминокислоты при росте метилотрофных бактерий на средах, содержащих 2 об. % СН3ОН и 98 об.% 2Н2O, и 1 об.% 13CH3OH и 99 об.% Н2О составляют 97,5% и 95% соответственно.
1. Smith K., Barua J. M., Watt P. W. // Am. J. Physiol. - 1992. - V. 262. - N 3. - P. 1372-1376.
2. McIntosh L. P., Dahlquist F. W. // Quarterly Reviews of Biophysics. - 1990. - V. 23. - N. 1. - P. 1-38.
3. Harbison G. S., Smith S. O., Pardoen J. A., Mulder P. P. J., Lugtenburg J., Herzfeld R., Mathies R., Griffin R. G. // Biochemistry. - 1984. - V. 23. - P. 2662-2667.
4. Ames J. B., Ros M., Raap J., Lugtenburg J., Mathies R. A. // Biochemistry. - 1992. - V. 31. - P. 5328-5335.
5. Fischer M. R., de Groot H. J. M., Raap J., Winkel C., Hoff A. J., Lugtenburg J. // Biochemistry. - 1992. - V. 31. - P. 11038-11043.
ХИМИКО-ФЕРМЕНТАТИВНЫЙ МЕТОД ПОЛУЧЕНИЯ ИЗОТОПНОМЕЧЕНЫХ АМИНОКИСЛОТ И БЕЛКОВ
Другим подходом по получению изотопномеченых аминокислот является химико-ферментативный метод, основанный на комбинации синтетических и ферментативных реакций. Для этого перспективно и экономически оправдано использование препаратов очищенных ферментов и их экстрактов, безклеточных ферментативных систем, а также иммобилизованных ферментов. Ферментативные реакции осуществляют на иммобилизованных ферментах, например, таких как аланиндегидрогеназе (КФ 1.4.1.1) в присутствии NADH при получении [2H]аланина [148], иммобилизованной на сахарозе фенилаланинаммонийлиазе (КФ 4.3.1.5) и фенилаланингидроксилазе (КФ 1.14.16.1), при получении [2H]фенилаланина [149] и [2H]тирозина [150], триптофансинтазе (КФ 4.2.1.20), при получении [2H]триптофана [151], глутаматдегидрогеназе (КФ 1.4.1.2), при получении [2H]глутаминовой кислоты [152], аспартазы (КФ 4.3.1.1), при получении [2Н]аспарагиновой кислоты [153] и серингидроксиметилазе (КФ 2.5.1.6) при получении [2H]серина [154].