Молекулярная физика воды
К.х.н. О.В. Мосин
МОЛЕКУЛЯРНАЯ ФИЗИКА ВОДЫ В ТРЕХ ЕЕ АГРЕГАТНЫХ СОСТОЯНИЯХ
Вода, окись водорода, H20, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе). Вода – это бесцветная жидкость без запаха и вкуса (в толстых слоях имеет голубоватый цвет), которой принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды на нашей планете. Вода — обязательный компонент практически всех технологических процессов — как сельскохозяйственного, так и промышленного производства.
Вода входит в состав всех живых организмов, причём в целом в них содержится лишь вдвое меньше воды, чем во всех реках Земли. В живых организмах количество воды, за исключением семян и спор, колеблется между 60 и 99,7% по массе. По словам французского биолога Э. Дюбуа-Реймона, живой организм есть l'eau animée (одушевлённая вода). Все воды Земли постоянно взаимодействуют между собой, а также с атмосферой, литосферой и биосферой.
Земной шар содержит около 16 млрд. км3 воды, что составляет 0,25 % массы всей нашей планеты. Из этого количества на долю гидросферы Земли (океаны, моря, озера, реки, ледники и подземные воды) приходится 1,386 млрд. км3. Пресные поверхностные воды (озера и реки) составляют всего лишь 0,2 млн. км3, а водяной пар атмосферы — 13 тыс. км3.
Общая масса распределенных по поверхности Земли снега и льда достигает примерно 2,5-3,0 x 1016 т, что составляет всего лишь 0,0004% массы всей нашей планеты. Однако, такого количества достаточно, чтобы покрыть всю поверхность Земного шара 53 метровым слоем, а если бы вся эта масса вдруг растаяла, превратившись в воду, то уровень Мирового Океана поднялся бы по сравнению с нынешним примерно на 64 метра.
Воды Земли пронизывают ее, начиная с самых больших высот стратосферы вплоть до огромных глубин земной коры, достигая мантии, и образуют непрерывную оболочку планеты - гидросферу, включающую в себя всю воду в жидком, твердом, газообразном, химически и биологически связном состоянии.
Гидросфера — водная оболочка Земли, включающая океаны, моря, озёра, водохранилища, реки, подземные воды, почвенную влагу, составляет около 1,4—1,5 млрд. км3, причём на долю воды суши приходится всего около 90 млн. км3. Из них подземные воды составляют 60, ледники 29, озёра 0,75, почвенная влага 0,075, реки 0,0012 млн. км3.
Гидросфера играла и играет основополагающую роль в геологической истории Земли, в формировании физической и химической среды, климата и погоды, в возникновении жизни на нашей планете. Она развивалась вместе и в тесном взаимодействии с литосферой, атмосферой, а затем и живой природой.
В атмосфере вода находится в виде пара, тумана и облаков, капель дождя и кристаллов снега (всего около 13—15 тыс. км3). Около 10% поверхности суши постоянно занимают ледники. На севере и северо-востоке СССР, на Аляске и Севере Канады — общей площадью около 16 млн. км2 всегда сохраняется подпочвенный слой льда (всего около 0,5 млн. км3.
В земной коре — литосфере содержится, по разным оценкам, от 1 до 1,3 млрд. км3 воды, что близко к содержанию её в гидросфере. В земной коре значительные количества воды находятся в связанном состоянии, входя в состав некоторых минералов и горных пород (гипс, гидратированные формы кремнезёма, гидросиликаты и др.). Огромные количества воды (13—15 млрд. км3) сосредоточены в более глубоких недрах мантии Земли. Выход воды, выделявшейся из мантии в процессе разогревания Земли на ранних стадиях её формирования, и дал, по современным воззрениям, начало гидросфере. Ежегодное поступление воды из мантии и магматических очагов составляет около 1 км3.
Имеются данные о том, что вода, хотя бы частично, имеет «космическое» происхождение: протоны, пришедшие в верхнюю атмосферу от Солнца, захватив электроны, превращаются в атомы водорода, которые, соединяясь с атомами кислорода, дают H2O.
Вода встречается в природных условиях в трех состояниях: твердом — в виде льда и снега, жидком — в виде собственно воды, газообразном — в виде водяного пара. Эти состояния воды называют агрегатными состояниями, или соответственно твердой, жидкой и парообразной фазами. Переход воды из одной фазы в другую обусловлен изменением ее температуры и давления. На рис. 1 приведена диаграмма агрегатных состояний воды в зависимости от температуры t и давления P. Из рис.1. видно, что в области I вода находится только в твердом виде, в области II — только в жидком, в области III — только в виде водяного пара. Вдоль кривой AC она находится в состоянии равновесия между твердой и жидкой фазами (плавление льда и кристаллизация воды); вдоль кривой AB — в состоянии равновесия между жидкой и газообразной фазами (испарение воды и конденсация пара); вдоль кривой AD — в равновесии между твердой и газообразной фазами (сублимация водяного пара и возгонка льда).
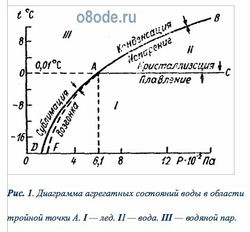
Равновесие фаз по рис.1 вдоль кривых AB, АС и AD надо понимать как динамическое равновесие, т. е. вдоль этих кривых число вновь образующихся молекул одной фазы строго равно числу вновь образующихся молекул другой фазы. Если, например, постепенно охлаждать воду при любом давлении, то в пределе окажемся на кривой AC, где будет наблюдаться вода при соответствующих температуре и давлении. Если постепенно нагревать лед при различном давлении, то окажемся на той же кривой равновесия АС, но со стороны льда. Аналогично будем иметь воду и водяной пар, в зависимости от того, с какой стороны будем подходить к кривой AB.
Все три кривые агрегатного состояния — АС (кривая зависимости температуры плавления льда от давления), АВ (кривая зависимости температуры кипения воды от давления), AD (кривая зависимости давления пара твердой фазы от температуры) — пересекаются в одной точке A, носящей название тройной точки. По современным исследованиям, значения давления насыщающих паров и температуры в этой точке соответственно равны: P = 610,6 Па (или 6,1 гПа = 4,58 мм рт. ст.), t = 0,01°C (или T = 273,16 К). Кроме тройной точки, кривая АВ проходит еще через две характерные точки — точку, соответствующую кипению воды при нормальном давлении воздуха с координатами P = 1,013·105 Па и t = 100°C, и точку с координатами P = 2,211·107 Па и tкр = 374,2°C, соответствующими критической температуре — температуре, только ниже которой водяной пар можно перевести в жидкое состояние путем сжатия.
Кривые АС, АВ, AD относящиеся к процессам перехода вещества из одной фазы в другую, описываются уравнением Клапейрона—Клаузиуса:
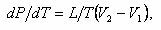
где T — абсолютная температура, отвечающая для каждой кривой соответственно температуре испарения, плавления, сублимации и т. д.; L — удельная теплота соответственно испарения, плавления, сублимации; V2 – V1 — разность удельных объемов соответственно при переходе от воды ко льду, от водяного пара к воде, от водяного пара ко льду.
Непосредственный опыт показывает, что природные воды суши при нормальном атмосферном давлении переохлаждаются (кривая AF) до некоторых отрицательных значений температуры не кристаллизуясь. Таким образом, вода обладает свойством переохлаждаться, т.е. принимать температуру ниже точки плавления льда. Переохлажденное состояние воды является состоянием метастабильным (неустойчивым), в котором начавшийся в какой-либо точке переход жидкой фазы в твердую продолжается непрерывно, пока не будет ликвидировано переохлаждение или пока не превратится в твердое тело вся жидкость. Способность воды принимать температуру ниже точки плавления льда была обнаружена впервые Фаренгейтом еще в 1724 г.
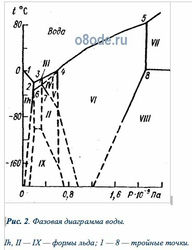
Рис. 2. Фазовая диаграмма воды. Ih, II — IX — формы льда; 1 — 8 — тройные точки.
Переохлаждение воды – термодинамическое состояние, при котором температура воды оказывается ниже температуры ее кристаллизации. Возникает это состояние в результате понижения температуры воды или же повышения температуры ее кристаллизации. Температура воды может быть понижена отводом тепла, что наиболее часто встречается в природе, или смешением ее с соленой, например морской, водой. Температура кристаллизации может быть повышена путем понижения давления.
В лабораторных условиях при большом давлении и интенсивном охлаждении дистиллированную воду можно переохладить до температуры порядка — 30, а капель — 50°С. От глубины переохлаждения воды зависит и скорость ее кристаллизации.
Таким образом, диаграмму агрегатных состояний воды — сплошная линия AD на рис. 1 — следует рассматривать как относящуюся к очень малым тепловым нагрузкам, когда влияние времени на преобразование фазы мало. При больших тепловых нагрузках процесс фазовых преобразований будет происходить согласно штриховой кривой AF.
Температура плавления льда (кривая AC) очень слабо зависит от давления. Практически кривая AC параллельна горизонтальной оси: при изменении давления от 610,6 до 1,013·105 Па температура плавления уменьшается всего лишь от 0,01 до 0°С. Однако эта температура понижается с увеличением давления только до определенного значения, затем она повышается и при очень высоком давлении достигает значения порядка 450°С (рис.1.2). Как следует из рис. 1.2, при высоком давлении лед может находиться и при положительной температуре. Насчитывают до десяти различных форм льда. Форма льда Ih, для которой характерно понижение температуры плавления с увеличением давления, соответствует обычному льду, образующемуся вследствие замерзания воды при нормальных условиях. Координаты тройных точек различных форм льда, обозначенных на рис.1.2 арабскими цифрами 1—8, приведены в табл. 1.1. Структура и физические свойства всех форм льда существенно отличаются от льда Ih.
Твердое тело (лед), как и жидкость, испаряется в широком диапазоне значений температуры и непосредственно переходит в газообразное состояние (возгонка), минуя жидкую фазу, — кривая AD. Обратный процесс, т. е. переход газообразной формы непосредственно в твердую (сублимация), осуществляется, также минуя жидкую фазу. Возгонка и сублимация льда и снега играют большую роль в природе.
Строение молекулы воды
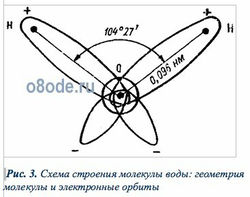
Рис. 3. Схема строения молекулы воды: геометрия молекулы и электронные орбиты
Полную кинетическую энергию трехатомной молекулы типа H2O можно описать следующим выражением:
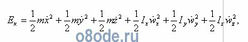
где и — скорости соответственно поступательного и вращательного движения молекулы; Ix, Iy, Iz — моменты инерции молекулы относительно соответствующих осей вращения; m — масса молекулы.
Из этого уравнения видно, что полная энергия трехатомной молекулы типа H2O состоит из шести частей, отвечающих шести степеням свободы: трем поступательным и трем вращательным.
Из курса физики известно, что на каждую из этих степеней свободы при тепловом равновесии приходится одинаковое количество энергии, равное 1/2 kT, где k=Rm/NA= 1,3807·10-23 Дж/К — постоянная Больцмана; Т—абсолютная температура; NA = 6,0220·1023 моль-1 — число Авогадро; kNA=Rm= 8,3144 Дж/(моль·К) — универсальная газовая постоянная. Тогда полная кинетическая энергия такой молекулы равна:
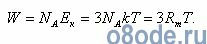
Полная кинетическая энергия молекул, содержащихся в грамм-молекуле любого газа (пара), составит:
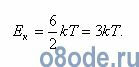
Полная кинетическая энергия W связана с удельной теплоемкостью cv при постоянном объеме формулой:
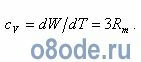
Подсчет удельной теплоемкости воды по этой формуле для водяного пара дает значение 25 Дж/(моль·К). По опытным данным, для водяного пара cv = 27,8 Дж/(моль·К), т. е. близко к расчетному значению.
Изучение молекулы воды с помощью спектрографических исследований позволило установить, что она имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы без ее колебаний и вращений.
Относительная молекулярная масса H2O зависит от относительной атомной массы ее составляющих и имеет различные значения, так как кислород и водород имеют изотопы.
Кислород имеет шесть изотопов: 14O, 15O, 16O, 17O, 18O, 19O, из которых стабильны только три, а водород три: 1H (протий), 2H (дейтерий), 3H (тритий). Некоторые из изотопов радиоактивны, имеют короткое время полураспада и присутствуют в воде в незначительных количествах, другие же получены только искусственным путем и в природе не встречаются.
Таким образом, принимая во внимание изотопы кислорода и водорода, можно составить из них несколько видов молекулы H2O с различными относительными молекулярными массами. Из них наиболее распространены молекулы 1H216O с относительными молекулярными массами 18 (обычная вода) и молекулы 2H216O с относительными молекулярными массами 20. Последние молекулы образуют так называемую тяжелую воду. Тяжелая вода по своим физическим свойствам значительно отличается от обыкновенной воды.
Молекулярно-кинетическая теория вещества и воды
Структура воды в трех ее агрегатных состояниях еще не может считаться окончательно установленной. Существует ряд гипотез, объясняющих строение пара, воды и льда.
Эти гипотезы в большей или меньшей степени опираются на молекулярно-кинетическую теорию строения вещества, основы которой были заложены еще М.В. Ломоносовым. В свою очередь, молекулярно-кинетическая теория исходит из принципов классической механики, в которой молекулы (атомы) рассматриваются как шарики правильной формы, электрически нейтральные, идеально упругие. Такие молекулы подвержены лишь механическим соударениям и не испытывают никаких электрических сил взаимодействия. По этим причинам использование молекулярно-кинетической теории может лишь в первом приближении объяснить строение вещества.
Газ — в нашем случае водяной пар, — согласно молекулярно-кинетической теории, представляет собой собрание молекул. Расстояние между ними во много раз больше размеров самих молекул. Молекулы газа находятся в непрерывном беспорядочном движении, пробегая путь между стенками сосудов, в котором заключен газ, и сталкиваясь друг с другом на этом пути. Соударения молекул между собой происходят без потери механической энергии; они рассматриваются как соударения идеально упругих шариков. Удары молекул о стенки ограничивающего их сосуда обусловливают давление газа на эти стенки. Скорость движения молекул увеличивается с повышением температуры и уменьшается с ее падением.
Когда температура газа, уменьшаясь от более высоких значений, приближается к температуре кипения жидкости (для воды 100°C при нормальном давлении), скорость молекул уменьшается, и при соударении силы притяжения между ними становятся больше сил упругих отталкиваний при ударе и поэтому газ конденсируется в жидкость.
При искусственном сжижении газа температура его должна быть ниже так называемой критической, которой отвечает и критическое давление (п.1.1). При температуре выше критической газ (пар) никаким давлением не может быть переведен в жидкость.
Величина RTкр/ (PкрVкр) для всех газов, в том числе и для водяного пара, должна быть равна 8/3=2,667 (здесь R — газовая постоянная; Tкр, Pкр, Vкр — соответственно критические температура, давление, объем). Однако для водяного пара она равна 4,46. Это объясняется тем, что в состав пара входят не только одиночные молекулы, но и их ассоциации.
Жидкость в отличие от газа представляет собой совокупность молекул, расположенных столь близко друг от друга, что между ними проявляются силы взаимного притяжения. Поэтому молекулы жидкости не разлетаются в разные стороны, как молекулы газа, а только колеблются около своего положения равновесия. Вместе с тем, так как строение жидкости не вполне плотное, в ней имеются свободные места — «дырки», вследствие чего, по теории Я.И.Френкеля, некоторые молекулы, обладающие большей энергией, вырываются из своего «оседлого» места и скачком перемещаются в соседнюю «дырку», расположенную на расстоянии, примерно равном размеру самой молекулы. Таким образом, в жидкости молекулы сравнительно редко перемещаются с места на место, а большую часть времени находятся в «оседлом» состоянии, лишь претерпевая колебательные движения. Этим, в частности, объясняется слабая диффузия в жидкостях по сравнению с большой ее скоростью в газах. При нагревании жидкости энергия ее молекул увеличивается, скорость их колебания возрастает. При температуре 100°C и нормальном атмосферном давлении вода распадается на отдельные молекулы H2O, скорость которых уже в состоянии преодолеть взаимное притяжение молекул, и вода превращается в пар.
При охлаждении жидкости (воды) происходит обратный процесс. Скорости колебательного движения молекул уменьшаются, структура жидкости становится более прочной, и жидкость переходит в кристаллическое (твердое) состояние—лед. Различают два вида твердых тел: кристаллические и аморфные. Основным признаком кристаллических тел является анизотропия их свойств по различным направлениям: теплового расширения, прочности, оптических и электрических свойств и т. п. Аморфные тела изотропны, т. е. обладают одинаковыми свойствами во всех направлениях. Лед является кристаллическим телом.
В твердом теле, в отличие от газа и жидкости, каждый атом или молекула колеблются только около своего положения равновесия, но не перемещаются. В твердом теле отсутствуют «дырки», в которые могут переходить отдельные молекулы. Поэтому диффузия в твердых телах отсутствует. Атомы, составляющие молекулы, образуют прочную кристаллическую решетку, неизменность которой обусловлена молекулярными силами. Когда температура твердого тела приближается к температуре плавления, кристаллическая решетка его разрушается, и оно переходит в жидкое состояние. В отличие от кристаллизации жидкостей плавление твердых тел происходит сравнительно медленно, без явно выраженного скачка.
Кристаллизация большинства жидкостей происходит с уменьшением объема, а плавление твердых тел сопровождается увеличением объема. Исключение составляют вода, сурьма, парафин и некоторые другие вещества, у которых твердая фаза менее плотная, чем жидкая.
Структура воды в трех ее агрегатных состояниях
Проблема оценки структуры воды пока остается одной из самых сложных. Рассмотрим кратко две обобщенные гипотезы о структуре воды, получившие наибольшее признание, одна — в начальный период развития учения о структуре воды, другая — в настоящее время.
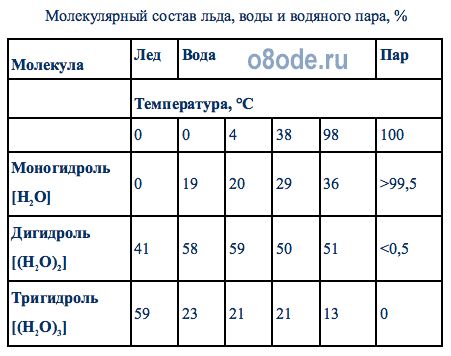
Согласно гипотезе, предложенной Уайтингом (1883г.) и имеющей к настоящему времени различные интерпретации, основной строительной единицей водяного пара является молекула H2O, называемая гидроль, или моногидроль. Основной строительной единицей воды является двойная молекула воды (H2O)2—дигидроль; лед же состоит из тройных молекул (H2O)3 — тригидроль. На этих представлениях основана так называемая гидрольная теория структуры воды.
Водяной пар, согласно этой теории, состоит из собрания простейших молекул моногидроля и их ассоциаций, а также из незначительного количества молекул дигидроля.
Вода в жидком виде представляет собой смесь молекул моногидроля, дигидроля и тригидроля. Соотношение числа этих молекул в воде различно и зависит от температуры. Согласно этой гипотезе, соотношение количества молекул воды и объясняет одну из основных ее аномалий — наибольшую плотность воды при 4°С.
Так как молекула воды несимметрична, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса — положительный и отрицательный, создающие, как магнит, молекулярные силовые поля. Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах:
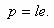
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м. Полярностью молекул моногидроля и объясняется образование дигидроля и тригидроля. Вместе с тем, так как собственные скорости молекул возрастают с повышением температуры, этим можно объяснить постепенный распад тригидроля в дигидроль и далее в моногидроль соответственно при таянии льда, нагревании и кипении воды.
Другая гипотеза строения воды, разрабатывавшаяся в XX веке (модели О.Я.Самойлова, Дж.Попла, Г.Н.Зацепиной и др.), основана на представлении, что лед, вода и водяной пар состоят из молекул H2O, объединенных в группы с помощью так называемых водородных связей (Дж.Бернал и Р.Фаулер, 1933г.). Эти связи возникают в результате взаимодействия атомов водорода одной молекулы с атомом кислорода соседней молекулы (с сильно электроотрицательным элементом). Такая особенность водородного обмена в молекуле воды обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра, почти лишенного электронной оболочки. Поэтому атом водорода не испытывает отталкивания от электронной оболочки кислорода соседней молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие. Согласно данной гипотезе, можно предположить, что силы, образующие водородную связь, являются чисто электростатическими. Однако, согласно методу молекулярных орбиталей, водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
В табл.1 показан молекулярный состав воды, льда и водяного пара по различным литературным источникам.
Таблица 1.1
Молекулярный состав льда, воды и водяного пара, %
Таким образом, в результате взаимодействия атомов водорода одной молекулы воды с отрицательными зарядами кислорода другой молекулы образуются четыре водородные связи для каждой молекулы воды. При этом молекулы, как правило, объединяются в группы — ассоциаты: каждая молекула оказывается окруженной четырьмя другими (рис. 4). Такая плотная упаковка молекул характерна для воды в замерзшем состоянии (лед Ih) и приводит к открытой кристаллической структуре, принадлежащей к гексогональной симметрии. При этой структуре образуются «пустоты — каналы» между фиксированными молекулами, поэтому плотность льда меньше плотности воды.
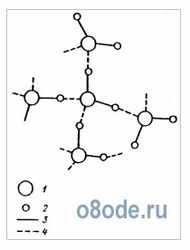
Рис. 4. Схема взаимодействия молекул воды. 1 — кислород, 2 — водород, 3 — химическая связь, 4 — водородная связь.
При повышении температуры воды до 4°С упорядоченность расположения молекул по кристаллическому типу с характерной структурой для льда до некоторой степени сохраняется. Имеющиеся в этой структуре отмеченные выше пустоты заполняются освободившимися молекулами воды. Вследствие этого плотность жидкости увеличивается до максимальной при температуре 3,98°С. Дальнейший рост температуры приводит к искажению и разрыву водородных связей, а, следовательно, и разрушению групп молекул, вплоть до отдельных молекул, что характерно для пара.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами.
Молекулы воды при конденсации формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x. Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации X для воды составляет, по современным данным, от 3 до 6. Это означает, что формула воды не просто Н2О, а среднее между Н6О3 и Н12О6. Другими словами, вода - сложная жидкость, "составленная" из повторяющихся групп, содержащих от трех до шести одиночных молекул. Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к её поверхности в виде осадков.
К.х.н. О.В. Мосин
Лучшая вещь которую я когда ли бы видел
Всё понял