К.х.н. О. В. Мосин
ВОДА КАК РАСТВОРИТЕЛЬ, ГИДРАТАЦИЯ И КЛАТРАТЫ
Вода – самое важное химическое соединение на Земле. Вода главный компонент всех живых организмов и той среды, в которой живёт и существует человек. Физические свойства воды резко отличаются от свойств других веществ, и характер этих различий определяет природу физического и биологического мира.
Одно из наиболее удивительных свойств воды — ее способность растворять многие вещества с образованием водных растворов. Раство ры — очень важное состояние вещества; они имеют весьма большое значение для промышленности и для жизненных процессов. Вода океа нов представляет собой водный раствор, содержащий тысячи компонентов: ионы металлов и неметаллов, комплексные неорганические ионы, множество различных органических веществ. Именно в этом растворе впервые возникли и развились живые организмы, и из него они получали ионы и молекулы, необходимые для их роста и жизни (более подробно об этом читайте на нашем сайте статью “Вода и жизнь” /article/planetwa/water_life2010.htm).
С течением времени жи вые организмы эволюционировали, что позволило им покинуть водную среду и перейти на сушу и подняться в воздух. Они приобрели эту спо собность, сохранив в своих организмах водный раствор в виде жидкой, составляющей ткани, плазмы крови и межклеточных жидкостей, содер жащих необходимый запас ионов и молекул.
Вода в отличие от органических растворителей хорошо растворяет соли, так как она обладает очень высокой диэлектрической проницаемостью (примерно 81 при комнатной температуре) и ее молекулы имеют тенденцию соединяться с ионами с обра зованием гидратированных ионов. Оба эти свойства обусловлены боль шим электрическим дипольным моментом 1 молекулы воды. И это свойство воды играет большую роль в развитии жизни и обмене веществ.
В воде происходит следующий процесс. Сила притяжения или отталкивания электрических зарядов обратно пропорциональна диэлектрической проницаемости среды, окружаю щей данные заряды. Это значит, что два противоположных электриче ских заряда взаимно притягиваются в воде с силой, равной 1/80 силы их взаимного притяжения в воздухе (или в вакууме). Поэтому, если кристалл соли хлорида натрия находится в воде, то образующие его ионы отделяются от кристалла значительно легче, чем если бы кристалл на ходился на воздухе, поскольку электростатическая сила, притягивающая ион обратно к поверхности кристалла из водного раствора, составляет лишь 1/80 силы притяжения данного иона из воздуха. Поэтому не удивительно, что при комнатной температуре тепловое движение не может вызвать переход ионов из кристалла в воздух, но в то же время тепло вого движения ионов вполне достаточно для преодоления относительно-слабого притяжения, когда кристалл окружен водой, что и приводит к переходу большого числа ионов в водный раствор.
Гидратация иона
При растворении солей в воде образуются гидратированные ионы. Образование гидратированных ионов приводит к стабилизации ионов в растворах воды. Каждый отрицательный ион притягивает положительные концы нескольких ближайших молекул воды и стремится удержать их около себя.
Положительные ионы, которые обычно меньше анионов, притягивают воду еще сильнее; каждый катион притягивает отрицательные концы молекул воды и прочно связывает несколько молекул, удерживая их около себя; при этом образуется гидрат, кото рый может быть весьма устойчивым, особенно в случае катионов, несу щих двойной или тройной положительный заряд.
Число молекул воды, присоединенных к данному катиону, его лигандность, определяется размерами катиона. Лигандность атома равна числу атомов, связанных с ним или находящихся с ним в контакте. Лигандность также называется координационным числом.
В воде небольшой катион Ве2+ образует тетрагидрат Be(OH2)42+. Несколько большие ионы, например Mg2+ или Аl3+, образуют гексагидраты Mg(OH2)62+, Аl(ОН2)63+ (рисунок 1).
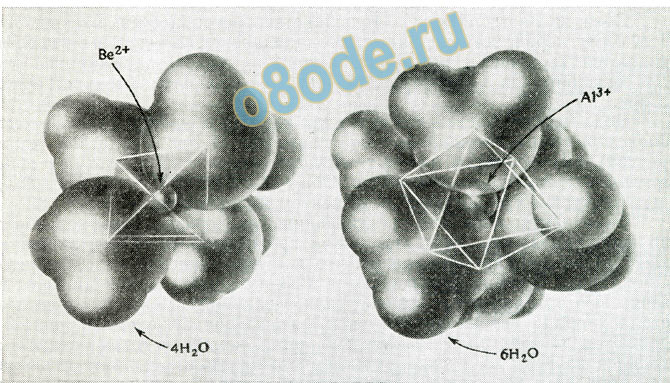
Рисунок 1. Структура гидратированных ионов Be(OH2)42+ и Аl(ОН2)63+.
В гидратированных ионах силы взаимодействия между катионами и молекулами воды настолько велики, что ионы часто удерживают вокруг себя слой из молекул воды даже в кристаллах. Такая вода называется кристаллизацион ной. Этот эффект ярче проявляется в случае двухи трехзарядных катио нов, чем в случае однозарядных. Например, тетрагидратный комплекс Ве(ОН2)42+ встречается в различных солях, в том числе в ВеСО3 .4Н2О, ВеС12 . 4Н2О и BeSO4 . 4H2O и несомненно присутствует в растворе.
Соли, содержащие более крупные ионы, например Соли магния, железа, алюминия и никеля, способны присоединять шесть молекул воды, которые располагаются в углах правильного октаэдра:
MgCl2 • 6H2O А1С13 • 6Н2О
Mg(C1О3)2 • 6H2O KA1(S04)2 • 12H2O
Mg(C1О4)2 • 6Н20 Fe(NH4)2 (SO4)2 • 6H2O
MgSiF6 • 6H2O Fe(NO3)2 • 6H2O
NiSnCl3 • 6H2O FeCl3 • 6H2O
В таком кристалле, как FeSO4.7H2O, шесть молекул воды присоединены к иону железа в виде комплекса Fe(OH2)62+, а седьмая зани мает в кристалле иное положение, располагаясь вблизи иона сульфата.
В квасцах KAl(SO4)2.12H2О шесть молекул воды из двенадцати связа ны с ионом алюминия, а остальные шесть расположены вокруг иона калия.
Существуют также кристаллы, в которых катионы лишены некото рой доли или всех молекул воды. Так, сульфат магния образует три кристаллических соединения: MgSO4 .7H2O, MgSO4.H2O и MgSO4.
Устойчивость ионов в водном растворе является результатом такого распределения электрического заряда между определенным числом атомов, при котором ни один атом не проявляет значительного откло нения от электронейтральности. Рассмотрим гидратированные катионы Ве(ОН2)42+ и А1(ОН2)63+, представленные на рисунке 1. Как бериллий, так и алюминий имеют электроотрицательность 1,5, а электроотрицательность кислорода равна 3,5. Разность электроотрицательностей соответствует ионности, немного превышающей 50%, достаточной для перемещения половины электрического заряда каждой связи на центральный атом, оставляя его примерно нейтральным. Связи О—Н могут иметь на 25% ионный характер, при этом весь заряд ионов перей дет на восемь атомов водорода в Ве(ОН2)42+ и на двенадцать атомов водорода в А1(ОН2)63+, каждый из которых будет иметь заряд ¼+ Кроме того, каждый из этих атомов водорода может участвовать в образовании слабой связи с другой молекулой воды таким образом, что его заряд будет нейтрализоваться взаимодействием с электронной па рой атома кислорода, и тогда общий заряд гидратированных катионов Ве(ОН2)4(ОН2)82+ и Al(OH2)6(OH2)123+ будет распределен между наи более отдаленными атомами водорода, каждый из которых будет иметь заряд 1/8+. Фактически такая электрическая поляризация воды распро страняется на большие расстояния; это и обусловливает высокую ди электрическую проницаемость воды.
Известно, что при образовании в водных растворах водородных связей такими молекулами, как Н3РО4, все четыре атома кислорода могут стать почти эквивалентными, обеспечивая почти полный резонанс двой ной связи между четырьмя положениями. При таком резонансе каждый атом кислорода имеет валентность 11/4, удовлетворяя по связям фосфор и оставляя 3/4 на связь с водородом. Если каждая из трех групп ОН использует свой атом водорода на образование слабой связи (в ¼ свя зи) с атомом кислорода молекулы воды, то остальные ¾ связи ока жутся достаточными, чтобы сделать атомы кислорода фосфата электрически нейтральными. Точно так же фосфатный кислород без атома во дорода может образовать слабые (в ¼) связи с атомами водорода трех соседних молекул воды, что делает его тоже электрически нейтральным.
Каждый из четырех атомов кислорода жизненно-важного фосфат-иона РО43подобным же образом может образовать водородные связи с тремя молекула ми воды. Электрический заряд гидратированного иона PO4(HOH)123будет тогда распределен между двенадцатью внешними атомами кис лорода, каждый с зарядом ¼-. Аналогичные гидратированные струк туры образуются ионами (НО)2РО2- и НОРО32-, которые присутствуют почти в равных количествах в живых организмах.
Клатратные соединения
Благородные газы (аргон и др.), простые углеводороды и многие другие вещества образуют с водой так называемые кристаллические гидраты; так, ксенон образует гидрат Хе . 53/4 Н2О, устойчивый примерно при 2°С и парциальном давлении ксенона 1 атм; метан образует аналогичный гидрат CH4 . 53/4 Н2О.
Рентгеноскопические исследования показали, что эти кристаллы имеют структуру, в которой молекулы воды образуют благодаря водородным связям решетку, напоминающую решетку льда; в ней каждая молекула воды окружена четырьмя другими молекулами, расположенными в вершинах тетраэдра на расстоянии 276 пм, но с более открытым расположением молекул, что обусловливает образование полостей (в форме пентагональных додекаэдров или других многогранников с пентагональными или гексагональными гранями), достаточно больших, чтобы в них могли помещаться атомы газов или другие молекулы (рисунок 2). Кри сталлы такого типа называют клатратными кристаллами.
Структура гидрата ксенона и гидратов аргона, криптона, метана, хлора, брома, сероводорода и некоторых других веществ показана на рис. 2. Кубическая ячейка данной структуры имеет ребро около 1200 пм и содержит 46 молекул воды.
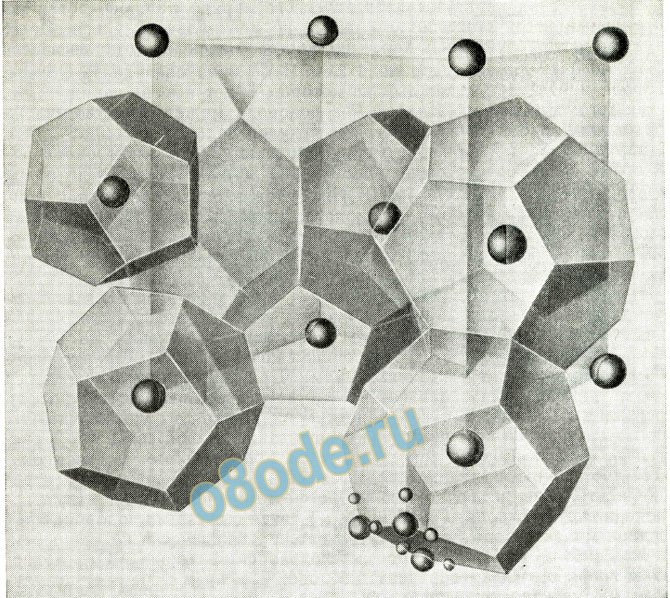
Рисунок 2. Структура клатратного кристалла гидрата ксенона.
Атомы ксенона занимают пустоты (восемь на кубическую ячейку) в трехмерной решетке, образо ванной молекулами воды с участием водородных связей (46 молекул на кубическую ячейку). Рас стояние О—Н • • • О равно 276 пм, как в кристалле льда. Два атома ксенона при атомах кислорода О О О и ½ ½ ½ находятся в центрах почти правильных пентагональных додекаэдров. Остальные шесть атомов ксенона при О ¼ ½; O ¾ ½; ½ O ¼; 1/2O ¾; ¼ ½ O находятся в центрах четырнадцатигранников. Каж дый четырнадцатигранник (один из них выделен в центре рисунка) имеет 24 вершины (молекулы воды), две шестиугольные грани и 12 пятиугольных граней.
Гидрат хлороформа СНС13 .17Н2О имеет несколько более сложную структуру, в которой молекула хлороформа окружена 16-сторонним многогранником, образованным 28 мо лекулами воды. Можно получить также клатратные соединения, в которых кри сталлическая решетка с водородными связями образована органически ми молекулами, например молекулами мочевины (H2N)2CO.
Была предложена интересная интерпретация механизма действия химически инертных анестезирующих средств, например галотана F3CCBrClH и ксенона. Согласно этому механизму, анестезирующее вещество нарушает водную структуру межклеточной или внутриклеточ ной жидкости путем образования клатратных структур, воздействую щих на нормальные межклеточные системы связи. Местные анестези рующие средства отличаются по механизму своего действия. Их молекулы могут образовать водородные связи, и, вероятно, анестезирующее действие является результатом соединения молекул анестезиру ющего вещества с белковыми молекулами или другими молекулами, входящими в состав нервов.
Другие растворители электролитов
Помимо воды и некоторые другие жидкости могут служить ионизирующими растворителями электролитов с образованием растворов, проводящих электрический ток. К таким жидкостям относятся перекись водорода, фтористый водород, жидкий аммиак и цианистый водород. Подобно воде, все эти жидкости имеют большую диэлектрическую прони цаемость. Жидкости с малой диэлектрической проницаемостью, такие, как бензол или сероуглерод, не являются ионизирующими растворите лями.
Жидкости с большой диэлектрической проницаемостью иногда называют полярными жидкостями.
Высокая диэлектрическая проницаемость воды, обуславливающая поразительную способность воды растворять вещества ионного строе ния, отчасти является следствием того, что вода способна образовывать водородные связи. Благодаря этим связям молекулы воды располагаются так, чтобы частично нейтрализовать электрическое поле. Водород ные связи образуются также и в других жидкостях - в перекиси водо рода, фтористом водороде, аммиаке (температура кипения — 33,4 °С), цианистом водороде], которые способны растворять вещества, облада ющие ионным строением.
Растворимость
Изолированная система находится в равновесии, когда ее свойства, в частности распределение компонентов между фазами, остаются по стоянными в течение длительного времени.
Если находящаяся в равновесии система состоит из раствора и другой фазы, представляющей собой один из компонентов раствора в виде чистого вещества, то концентрация этого вещества в растворе на зывается растворимостью данного вещества. Раствор в этом случае называют насыщенным.
Например, раствор буры при 0°С, содержащий 1,3 г безводного тетрабората натрия Na2B4O7 в 100 г воды, находится в равновесии с твердой фазой Na2B4O7. 10H2О (декагидратом тетрабората натрия); со временем эта система не изменяется, состав раствора остается постоянным. Растворимость Na2B4O7. 10H2О в воде составляет, следовательно, 1,3 г Na2B4O7 на 100 г или, учитывая гидратационную воду, 2,5 г Na2B4O7. 10H2О на 100 г воды.
Изменение в твердой фазе
Растворимость Na2B4O7. 10H2О с повышением температуры быстро возрастает; при 60 °С растворимость достигает уже 20,3 г Na2B4O7 на 100 г. (рисунок 3). При нагревании системы до 70 °С и выдерживании в течение некоторого времени при этой температуре наблюдается новое явление — появляется третья фаза — кристаллическая, имеющая состав Na2B4O7. 5H2О, а прежняя кристаллическая фаза исчезает. При этой температуре растворимость декагидрата выше, чем растворимость пентагидрата; раствор, насыщенный декагидратом, оказывается пересы щенным по отношению к пентагидрату, и поэтому из такого раствора выпадают кристаллы пентагидрата. Чтобы вызвать процесс кристаллизации, иногда к раствору необходимо доба вить «затравку» (небольшие кристаллики вещества, которое растворено в данном растворе). В дальнейшем идет процесс рас творения неустойчивой фазы и кристаллизации устойчивой до тех пор, пока неустойчивая фаза не исчезнет. Третий гидрат тетрабората натрия — кернит Na2B4O7. 4H2О — обладает большей растворимостью, чем два других.
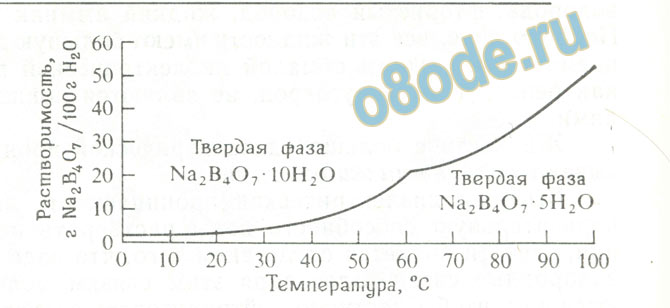
Рисунок 3. Растворимость Na2SO4 . 10H2O в зависимости от температуры
В рассмотренном случае декагидрат менее растворим, чем пентагидрат при температуре до 61 °С, и он является, следовательно, устой чивой фазой ниже этой температуры. Кривые растворимости этих двух гидратов пересекаются при 61 °С, причем выше этой температуры пентагидрат устойчив в контакте с раствором.
В устойчивой твердой фазе, помимо сольватации, могут происходить и другие процессы. Так, ромбическая сера в определенных рас творителях менее растворима, чем моноклинная, при температурах ни же 95,5 °С, т. е. ниже температуры взаимного превращения этих двух форм; выше указанной температуры моноклинная форма менее раство рима. Принципы термодинамики требуют, чтобы температура, при ко торой кривые растворимости двух форм вещества пересекаются, была одной и той же для всех растворителей и в то же время была температурой, при которой пересекаются кривые давления насыщенного пара.
Зависимость растворимости от температуры
Растворимость вещества с повышением температуры может увели чиваться или уменьшаться. В этом отношении убедительным примером служит сульфат натрия. Растворимость Na2SO4 .10H2O (устойчивая твердая фаза ниже 32,4 °С) очень быстро возрастает с повышением температуры, увеличиваясь от 5 г Na2SO4 на 100 г воды при 0°С до 55 г при 32,4°С. Выше 32,4 °С устойчивой твердой фазой является Na2SO4; растворимость этой фазы быстро уменьшается с повышением темпера туры: от 55 г при 32,4 °С до 42 г при 100 °С (рисунок 4).
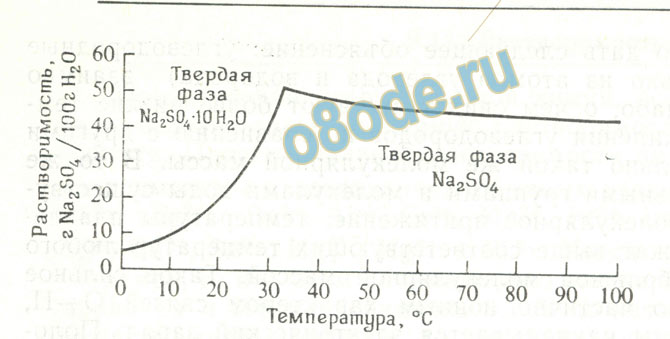
Рисунок 4. Растворимость Na2SO4 . 10H2O в зависимости от температуры
Растворимость большинства солей с повышением температуры возрастает; растворимость многих солей (NaCl, К2СrO7) только немного изменяется с повышением температуры; и лишь некоторые соли, напри мер Na2SO4, FeSO4.H2O и Na2CO3.H2O, обладают растворимостью, уменьшающейся с повышением температуры (рисунок 4 и рисунок 5).
Рисунок 5. Кривые растворимости некоторых солей в воде
Зависимость растворимости от природы растворенного вещества и растворителя
Растворимость веществ сильно меняется в разных растворителях., Тем не менее установлено несколько общих правил, относящихся к растворимости, которые применимы главным образом к органическим со единениям.
Одно из этих правил гласит, что вещество имеет тенденцию растворяться в таких растворителях, которые химически подобны ему. Так, углеводород нафталин С10Н8 обладает высокой растворимостью в бен зине, представляющем собой смесь углеводородов, несколько меньшей растворимостью — в этиловом спирте С2Н5ОН, молекулы которого состоят из коротких углеводородных цепей с гидроксильными группами, и очень плохой растворимостью — в воде, которая сильно отличается от углеводородов. В то же время борная кислота В(ОН)3, являющаяся гидроокисью, обладает умеренной растворимостью в воде и в спирте, т. е. в веществах, которые содержат гидроксильные группы, и нерастворима в бензине. Три указанных растворителя сами подтверждают то же правило: как бензин, так и вода смешиваются со спиртом (раство ряются в нем), в то время как бензин и вода взаимно растворяются лишь в очень небольших количествах.
Этим фактам можно дать следующее объяснение: углеводородные группы (состоящие только из атомов углерода и водорода) взаимно притягиваются очень слабо, о чем свидетельствуют более низкие тем пературы плавления и кипения углеводородов по сравнению с другими веществами приблизительно такой же молекулярной массы. В то же время между гидроксильными группами и молекулами воды существу ет очень сильное межмолекулярное притяжение; температуры плавле ния и киления воды лежат выше соответствующих температур любого другого вещества с небольшой молекулярной массой. Такое сильное притяжение обусловлено частично ионным характером связей О—Н, благодаря чему на атомы накладывается электрический заряд. Поло жительно заряженные атомы водорода притягиваются затем к отрица тельно заряженным атомам кислорода других молекул, образуя водо родные связи и прочно удерживая молекулы вместе.
Термин гидрофильный часто применяют по отношению к веществам или группам, притягивающим воду, а термин гидрофобный применяют по отношению к веществам или группам, отталкивающим воду и при тягивающим углеводороды. В действительности молекулы гидрофобного вещества воздействуют силами электронного вандерваальсова притяжения как на молекулы воды, так и на молекулы углеводородов. Растворимость паров воды, например, в керосине (смеси углеводородов) при 25 °С и давлении 0,0313 атм (т. е. при давлении насыщенного пара над жидкой водой при этой температуре) составляет 72 мг в 1 кг рас творителя, в то время как растворимость метана при том же парци альном давлении несколько меньше—10 мг в 1 кг керосина. Молекулы воды притягиваются молекулами керосина несколько сильнее, нежели молекулы метана. Различие между водой и метаном заключается в том, что при более высоких парциальных давлениях пары воды конденси руются в жидкость, которая стабилизируется межмолекулярными во дородными связями, тогда как метан продолжает оставаться газом.
Растворимость метана в полярных растворителях почти та же, что и в неполярных; в спиртах от метанола СН3ОН до пентанола (амилового спирта) С5Н11ОН растворимость метана составляет 72—80% зна чения для керосина. Силы вандерваальсова притяжения молекул рас творителя в отношении молекул метана остаются почти одинаковыми для разных растворителей. С другой стороны, растворимость водяных паров при давлении 0,313 атм в амиловом спирте в 1400 раз больше, чем в керосине, и вода смешивается в любых соотношениях с легкими спиртами.
Вещества, состоящие из небольших неполярных молекул, например кислород, азот и метан, растворяются в воде примерно в 10 раз хуже, чем в неполярных растворителях. Вещества, состоящие из более крупных неполярных молекул, по существу не растворяются в воде, но, как правило, хорошо растворяются в неполярных растворителях. Вода как бы противодействует включению этих молекул, поскольку образование необходимых для этого пустот сопряжено с разрывом или деформацией водородных связей между молекулами воды. Соединения, подобные бен зину и нафталину, не растворяются в воде, поскольку их молекулы в растворе мешали бы молекулам воды образовывать столь же большое число прочных водородных связей, как в чистой воде; с другой сторо ны, борная кислота растворима в воде потому, что уменьшение числа связей между молекулами воды компенсируется образованием прочных водородных связей между молекулами воды и гидроксильными группа ми молекул борной кислоты.
Растворимость солей и гидроокисей в воде
При изучении неорганической химии, особенно качественного анализа, полезно знать примерную растворимость широко применяющихся веществ. Простые правила растворимости приведены ниже. Эти прави ла применимы к соединениям обычных катионов: Na+, K+, NH4+, Mg2+, Са2+, Sr2+, Ва2+, Al3+, Cr3+, Mn2+, Fe2+, Fe3+, Co2+, Ni2+, Cu2+, Zn2+, Ag+, Cd2+, Sn2+ , Hg22+ , Hg2+ и РЬ2+. Когда говорят, что вещество «рас творимо», то под этим понимают, что растворимость его превышает при мерно 1 г в 100 мл (примерно 0,1 М по катиону), а когда говорят, что вещество «нерастворимо», то это значит, что растворимость его не превышает 0,1 г в 100 мл (приблизительно 0,01 М): вещества с растворимостью в этих пределах или близких к ним называют умеренно раство римыми.
Класс растворимых веществ:
Все нитраты растворимы.
Все ацетаты растворимы.
Все хлориды, бромиды и иодиды растворимы, за исключением со ответствующих соединений серебра, ртути (I) (ртути со степенью окис ления + 1) и свинца. Соединения РbС12 и РbВr2 умеренно растворимы в холодной воде (1 г в 100 мл при 20 °С) и лучше растворимы в горячей воде (3 и 5 г в 100 мл при 100°С соответственно).
Все сульфаты растворимы, за исключением сульфатов бария, строн ция и свинца. Умеренно растворимы CaSO4, Ag2SO4 и Hg2SO4.
Все соли натрия, калия и аммония растворимы: исключение составляют NaSb(OH)6 (антимонат натрия), K2PtCl6 (гексахлрроплатинат калия), (NH4)2PtCl6, К3Со(ТО2)6 (гексанитрокобальтат калия), (NH4)зСо(NO2)6 и КсlO4.
Класс нерастворимых веществ:
Все гидроокиси нерастворимы, за исключением гидроокисей щелочных металлов, аммония и бария; Са(ОН)2 и Sr(OH)2 умеренно растворимы.
Все средние карбонаты и фосфаты нерастворимы, за исключением соответствующих соединений щелочных металлов и аммония. Многие кислые карбонаты и фосфаты, например Са(НСО3)2 иСа(Н2РО4)2, растворимы.
Все сульфиды, за исключением сульфидов щелочных металлов, аммония и щелочноземельных металлов, нерастворимы.
К. х. н. О. В. Мосин
Литературный источник: Л. Полинг, П. Полинг. / перевод М. В. Сахарова. Ред. М. Л. Карапетьянц. Химия., Москва 1978 г.