Понизить содержание тяжёлой воды в питьевой воде
Как определить качество питьевой воды?
Вопрос:
Уважаемый Мосин О. В.! Прошу ответить на 2 вопроса:
1. Возможно ли в домашних условиях определить приблизительно наличие большого содержания тяжелой воды в питьевой воде? Как его понизить?
2. Какой прибор предпочтительней иметь дома для определения одного из параметров качества питьевой воды-солемер или определитель Рн?
С уважением, А. Плотников.
Ответ:
Обычная питьевая вода только на 99,7% состоит из легкой воды, молекулы которой образованы легкими атомами водорода и кислорода. В виде примеси в любой природной воде присутствует и тяжёлая вода, которая в чистом виде является ядом для всего живого.
Тяжёлая вода (оксид дейтерия) — имеет ту же химическую формулу, что и обычная вода, но вместо атомов водорода содержит два тяжёлых изотопа водорода — атомы дейтерия. Формула тяжёловодородной воды обычно записывается как: D2O или 2H2O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха, а вот по своим физико-химическим свойствам и негативному воздействию на организм тяжёлая вода сильно отличается от лёгкой воды.
Тяжёлая вода применяется в ядерной физике и энергетике в качестве замедлителя нейтронов и теплоносителя в ядерных реакторах, а также как исходный продукт для получения дейтерия. Тяжёлая вода применяют в химии, биологии, гидрологии как изотопный индикатор. На живые организмы даже небольшие количества тяжёлая вода действуют угнетающе, а большие дозы вызывают их гибель.
В тонне речной воды содержится 15 г тяжелой воды из расчёта 0,015%. За 70 лет потребления 3 л питьевой воды в день через организм человека пройдет около 80 тонн воды, содержащей 10-12 кг дейтерия и значительное количество коррелирующих с ним изотопов водорода – трития 3Н и кислорода 18О.
Тритий – бета-радиоактивный элемент с периодом полураспада 12,26 лет. Он образуется под действием жёсткого радиои нейтронного излучения в реакторах. В земных условиях тритий зарождается в высоких слоях атмосферы, где идут природные ядерные реакции. Он является одним из продуктов бомбардировки атомов азота нейтронами космического излучения. Ежеминутно на каждый квадратный сантиметр земной поверхности падают 8-9 атомов трития.
В небольших количествах сверхтяжелая (тритиевая) вода попадает на Землю в составе осадков. Во всей гидросфере одновременно насчитывается лишь около 20 кг Т20.
Тритиевая вода распределена неравномерно: в материковых водоемах ее больше, чем в океанах; в полярных океанских водах ее больше, чем в экваториальных. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при 104°С, замерзает при 4...9°С, имеет плотность 1,33 г/см3.
Однако список “изотопных” разновидностей воды не ограничивается дейтерием и тритием. Существует также и полутяжёлая (или дейтериевая) вода, у которой только один атом водорода замещен дейтерием. Формулу такой воды записывают так: DHO.
Вообще, строго говоря термин тяжёлая вода применяют также по отношению к воде, у которой любой из атомов заменен тяжёлым изотопом:
к тяжёлокислородной воде (в ней лёгкий изотоп кислорода 16O замещен тяжёлыми изотопами 17O или 18O);
- к тритиевой и сверхтяжёлой воде (содержащей вместо атомов 1H его радиоактивный изотоп тритий 3H);
А если подсчитать все возможные различные соединения с общей формулой Н2О, то общее количество возможных «тяжёлых вод» достигнет 48. Из них 39 вариантов — радиоактивные, а стабильных вариантов всего девять:
Н216O, Н217O, Н218O, HD16O, HD17O, HD18O, D216O, D217O, D218O.
Таким образом, возможно существование молекул воды, в которых содержатся любые из пяти водородных изотопов в любом сочетании.
Этим не исчерпывается сложность изотопного состава воды. Существуют также изотопы кислорода. В периодической системе химических элементов Д.И. Менделеева значится всем известный кислород 16O. Существуют еще два природных изотопа кислорода – 17O и 18O. В природных водах в среднем на каждые 10 тысяч атомов изотопа 16O приходится 4 атома изотопа 17O и 20 атомов изотопа 18O.
Тяжёлокислородная вода 1Н218О содержится в обычной питьевой воде в гораздо большей концентрации, чем тяжёлая вода - примерно 0,1%. Хотя по своим физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная. Получают ее в основном перегонкой природной воды и используют для изотопных исследований обмена веществ.
По физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная. Получают ее в основном перегонкой природной воды и используют как источник препаратов с меченым кислородом.
Помимо природных, существуют и шесть искусственно созданных изотопов кислорода. Как и искусственные изотопы водорода, они недолговечны и радиоактивны. Из них: 13O, 14O и 15O – легкие, 19O и 20O – тяжелые, а сверхтяжелый изотоп – 24O получен в 1970 году.
Существование пяти водородных и девяти кислородных изотопов говорит о том, что изотопных разновидностей воды может быть 135. Наиболее распространены в природе 9 устойчивых разновидностей воды.
Основную массу природной воды – свыше 99% – составляет протиевая вода – 1H216O. Тяжелокислородных вод намного меньше: 1H218O – десятые доли процента.
1H217O – сотые доли от общего количества природных вод. Только миллионные доли процента составляет тяжелая вода D2O, зато в форме 1HDO тяжелой воды в природных водах содержится уже заметное количество.
Еще реже, чем D2O, встречаются и девять радиоактивных естественных видов воды, содержащих тритий.
Классической водой следует считать протиевую воду 1H216O в чистом виде, то есть без малейших примесей остальных 134 изотопных разновидностей. И хотя содержание протиевой воды в природе значительно превосходит содержание всех остальных вместе взятых видов, чистой 1H216O в естественных условиях не существует. Во всем мире такую воду можно отыскать лишь в немногих специальных лабораториях. Ее получают очень сложным путем и хранят с величайшими предосторожностями. Для получения чистой 1H216O ведут очень тонкую, многостадийную очистку природных вод или синтезируют воду из исходных элементов 1H2 и 16O, которые предварительно тщательно очищают от изотопных примесей. Такую воду применяют в экспериментах и процессах, требующих исключительной чистоты химических реактивов.
Но самый большой эффект наблюдается для пары протий/дейтерий. Этим двукратным увеличением массы дейтерона относительно протона и обуславливаются так называемые изотопные эффекты тяжёлой воды - энергия связи, константа диссоциации, подвижность, длина связи и т.д.
Такое большой изотопный эффект для пары протий/дейтерий в воде, являющейся матрицей жизни, уже к наступлению половой зрелости человека повреждает его гены, вызывает различные болезни, рак, инициирует старение организма.
Массивное повреждение генофонда радиоактивными и тяжелыми изотопами водорода и кислорода воды может вызвать вымирание видов растений, животных и человека. По мнению многих учёных, человеку даже грозит вымирание, если он не перейдет на употребление лёгкой воды, обедненной радиоактивными и тяжелыми изотопами 18О и 2Н. Именно поэтому в начале XXI-го века среди учёных раздались голоса о полном исключении тяжёлых изотопов дейтерия 2Н и кислорода 18О из потребляемой питьевой воды.
Задача эта далеко не простая. Как уже говорилось на нашем сайте, она достигается различными физико-химическими методами – изотопным обменом водорода на дейтерий в присутствии катализатора H2S, многоступенчатым электролизом, вакуумной заморозкой с последующим оттаиванием, колоночной ректификацией, ультрацентрифугированием, фракционированием жидкого азота и др. Об этих методах неоднократно говорилось на нашем сайте.
Электролиз стал первым способом производства тяжелой воды. До 1940 года норвежский завод в Рьюкане был единственным поставщиком тяжелой воды, необходимой в качестве замедлителя нейтронов при изготовлении атомного оружия. Для получения чистой на 99,9% тяжелой воды необходим электролитический каскад из 15 ступеней. Образующееся при этом некоторое количество легкой воды называется остаточным. Остаточный метод получения легкой воды не пригоден для производства питьевой воды, так как эта вода содержит щелочной электролит и ряд других химических загрязнений. Несмотря на это некоторые пытаются использовать ее в качестве питьевой воды.
Затем были разработаны испарительно-конденсационный и другие (с вымораживанием и т.д.) технологические процессы и построены установки для получения биологически активной воды со сниженным содержанием дейтерия. Например, учёные установили, что при температуре в пределах 0-1,8°С молекулы воды с дейтерием и тритием в отличие от протиевой воды находятся в метастабильно-твердом неактивном состоянии. Это свойство лежит в основе фракционного разделения легкой и тяжелой воды путем создания разряжения воздуха над поверхностью воды при этой температуре. Протиевая вода интенсивно испаряется, а затем улавливается при помощи морозильного устройства, превращаясь в снег и лед. Тяжелая же вода, находясь в неактивном твердом состоянии и имея значительно меньшее парциальное давление, остаётся в испарительной емкости исходной воды вместе с растворенными в воде солями тяжелых металлов, нефтепродуктами, моющими средствами и другими вредными и ядовитыми веществами.

Известна зависимость давления пара над открытой поверхностью (зеркалом) воды от температуры при нормальном давлении. Так, при 0°С давление пара составляет 4,6 мм рт.ст. С повышением температуры воды до +10 °С давление пара возрастает до 9,2 мм рт.ст., то есть в два раза, а при 100°С оно соответствует 760 мм.рт.ст. Подсчет показывает, что с увеличением температуры от 0°С до 40°С давление пара над зеркалом воды возрастает в 10 раз, а при 100°С - в 160 раз. Интенсивность испарения легкой и тяжелой воды коррелируется в зависимости от температуры и разряжения над поверхностью воды. Данные, полученные в лабораторных условиях, свидетельствуют о существенном влиянии температуры воды перед ее испарением на содержание дейтерия в талой воде, полученной из замороженного холодного пара.

Рис. Лёд из обычной воды плавает на поверхности воды.
Рис. Лёд, образованный тяжёлой водой не плавает на поверхности воды, а тонет.
Таблица Физические свойства обычной и тяжёлой воды

Наша планета – гигантский испарительный реактор по разделению лёгких и тяжёлых изотопов. Астрономы считают, что гравитационное поле Земли – недостаточно сильно для удержания водорода, и наша планета постепенно теряет водород в результате его диссоциации в межпланетное пространство. Водород улетучивается быстрее тяжелого дейтерия, который способен накапливаться. Так что в течение всей эволюции должно происходить накопление дейтерия в атмосфере и в поверхностных водах. Таким образом, на Земле функционирует гигантский процесс кругооборота водорода и дейтерия.
Блестящим подтверждением этой гипотезы стали данные, полученные при бурении антарктического льда на российской станции “Восток”. Поднятый там на поверхность ледовый керн (колонка льда), имея общую протяженность 3600 м, охватил слой льда, сформировавшийся за 420 тысяч лет. Помимо анализа газового состава пузырьков воздуха, сохранившихся во льду за многие тысячелетия, исследователи получили возможность проследить за изменениями температуры по содержанию во льду тяжелого изотопа водорода — дейтерия δD. Метод основывается на том, что пары обычной воды и «тяжёлой» (т. е. содержащей дейтерий) различаются температурой конденсации. Последние конденсируются и выпадают при меньшем охлаждении, чем обычные, «легкие», что и отражается составом льда, который при этом образуется. При потеплении дейтерия становится больше, а при похолодании меньше. Данные по ледовому керну со станции «Восток» до недавнего времени содержали самый длинный ряд наблюдений за температурой — 420 тыс. лет (опубликованы в журнале Nature в 1999 г.).
Для определения содержания дейтерия и тяжёлой воды используют такие методы как масс-спектральный анализ, методы инфракрасной, атомной адсорбционной спектроскопии, денсиметрию, изотопный обмен. Визуально по форме кристаллов льда невозможно определить наличие тяжёлой воды в воде.
Рассмотрим каждый из этих методов.
Масс-спектроскопия, масс-спектрометрия, масс-спектральный анализ, метод исследования вещества путём определения масс ионов этого вещества (чаще отношений масс ионов к их зарядам) и их количеств. Совокупность значений масс и их относительных содержаний называется масс-спектром.
В масс-спектроскопии используется разделение в вакууме ионов разных масс под воздействием электрических и магнитных полей. Поэтому исследуемое вещество прежде всего подвергается ионизации. Процесс ионизации исключается при изучении ионного состава уже ионизованных газов, например в электрическом разряде или в ионосферах планет. В случае жидких и твёрдых веществ их либо предварительно испаряют, а затем ионизуют, либо же применяют поверхностную ионизацию, при которой образовавшиеся ионы вылетают в вакуум. Чаще исследуются положительные ионы, так как существующие методы ионизации позволяют получать их более простыми путями и в больших количествах, чем отрицательные. Однако в ряде случаев исследуют и отрицательные ионы.
Масс-спектральный анализ элементного состава вещества особенно точен, когда это вещество испаряется в виде исходных нераспавшихся молекул и заметная доля этих молекул не распадается в ионном источнике масс-спектрометра. Тогда, применяя масс-спектрометры с высокой разрешающей способностью, можно, например, однозначно определить число атомов С, Н, О и других в молекуле органического вещества по массе молекулярного иона. Для анализа элементного состава труднолетучих веществ применяют ионизацию методом вакуумной искры. При этом достигается высокая чувствительность (~10-5-10-7 %) и универсальность при умеренной точности в определении содержания компонент (от нескольких % до десятых долей %). Качественный молекулярный масс-спектральный анализ смесей основан на том, что масс-спектры молекул разного строения различны, а количественный - на том, что ионные токи от компонент смеси пропорциональны содержаниям этих компонент.
Первые масс-спектры были получены в Великобритании Дж. Дж. Томсоном (1910), а затем Ф. Астоном (1919). Они привели к открытию стабильных изотопов. Вначале масс-спектроскопия-с. применялась преимущественно для определения изотопного состава элементов и точного измерения атомных масс. Масс-спектроскопия-с. до сих пор является одним из основных методов, с помощью которых получают данные о массах ядер и атомных массах элементов. Вариации изотопного состава элементов могут быть определены с относительной погрешностью ±10-2 %, а массы ядер - с относительной погрешностью ±10-5 % для лёгких и ±10-4 % для тяжёлых элементов.
Высокая точность и чувствительность масс-спектроскопии как метода изотопного анализа привели к её применению и в других областях, где существенно знание изотопного состава элементов, прежде всего в ядерной технике. В геологии и геохимии масс-спектральное определение изотопного состава ряда элементов (свинца, аргона и других) лежит в основе методов определения возраста горных пород и рудных образований. Масс-спектроскопия широко используется в химии для элементного и молекулярного структурного анализа.
В физико-химических исследованиях масс-спектроскопия применяется при исследованиях процессов ионизации, возбуждения частиц и других задач физической и химической кинетики; для определения потенциалов ионизации, теплот испарения, энергий связи атомов в молекулах и тому подобного. С помощью масс-спектроскопии проведены измерения нейтрального и ионного состава верхней атмосферы Земли (возможны аналогичные измерения состава атмосфер других планет). Высокая абсолютная чувствительность метода Масс-спектроскопия-с. позволяет использовать его для анализа очень небольшого количества вещества (~10-12 г).
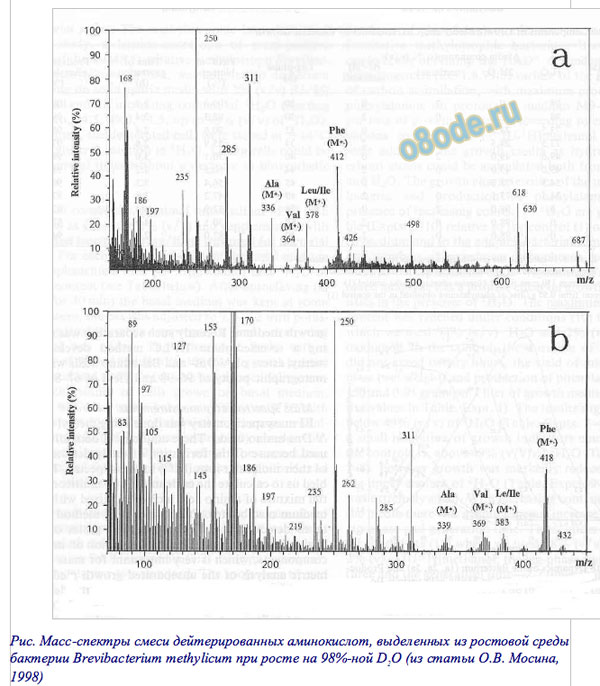
Рис. Масс-спектры смеси дейтерированных аминокислот, выделенных из ростовой среды бактерии Brevibacterium methylicum при росте на 98%-ной D2O (из статьи О.В. Мосина, 1998)
Масс-спектрограф (массовый спектрометр), прибор для отделения ионов по их массе (или, точнее, по отношению их заряда к массе). В самой простой модификации, ионы сначала ускоряются электрическим полем, а потом отклоняются мощным магнитным полем: чем легче ионы, тем больше отклонение. Масс-спектрограф отклоняет линию получающегося в результате массового спектра на фотографических пластинах; в масс-спектрометре это делается электрическим способом. При изменении поля ионы различной массы могут фокусироваться друг за другом на фотопластинке или детекторе, и получается фиксация отношения заряда к массе.
Денсиметрия (от лат. densus - плотный, густой и метрия), совокупность методов измерения относительной плотности жидких и твёрдых тел. В лабораторной практике распространены методы, основанные на законе Архимеда: относительную плотность определяют по глубине погружения ареометра в исследуемую жидкость или по результатам взвешивания жидкости или твёрдого тела на гидростатических весах. С высокой точностью относительную плотность можно измерить пикнометром, взвешивая сначала пустой пикнометр, затем заполненный дистиллированной водой и, наконец, - исследуемой жидкостью; значение плотности получают из отношения массы исследуемой жидкости к массе воды. В промышленности относительную плотность измеряют с помощью различных автоматических плотномеров, устанавливаемых в технологической линии. Действие таких плотномеров основано на непрерывном взвешивании определённого объёма жидкости; на измерении давления столба жидкости постоянной высоты (гидростатические плотномеры); на учёте изменения скорости распространения звука в зависимости от плотности жидкости (ультразвуковые плотномеры); на измерении рассеяния g-лучей (радиоактивные плотномеры). Существуют плотномеры, действие которых основано и на др. принципах.
Поскольку относительная плотность постоянна для каждого химически однородного вещества и для растворов при данной температуре, то по значению плотности можно судить о наличии примесей в веществе и о концентрации раствора. Это позволяет применять Денсиметрия для исследовательских работ и для производственного контроля в различных отраслях промышленности.
Изотопное разбавление. В изотопных исследованиях с тяжёлой и тритиевой водой часто используют метод изотопного разбавления. Пусть надо проанализировать содержание со единения А в смеси, которую невозможно количественно разде лить на отдельные компоненты.
Эту задачу можно выполнить следующим образом. К смеси добавляют небольшое количество А, содержащего известную примесь радиоактивного изотопа. Единственное условие дальнейшего анализа состоит в том, что бы можно было хотя бы частично отделить из смеси компонент А в чистом виде. Введем коэффициент разбавления, равный от ношению удельной активности изотопа А до разбавления к удельной активности того же изотопа после разбавления. Для стабильных изотопов отношение концентраций конкретного изо топа до и после разбавления во многих случаях можно опреде лить с помощью масс-спектрометра. Исходя из коэффициента разбавления и количества добавленного компонента А, можно рассчитать концентрацию А в исходной смеси.
Метод изотопного разбавления можно использовать, например, для определения общего количества воды в организме. Для этого вводят известное количество воды, содержащей определен ную примесь радиоактивного трития. Через некоторое время, тре буемое для полного смешивания введенной воды с остальной ее частью, отбирают образец сыворотки крови и измеряют в нем удельную активность трития. Если при этом оказалось, что коэффициент разбавления равен, например, 800, то полное количе ство воды в организме в 800 раз превышает объем воды, введен ной в эксперименте.
Метод изотопного обмена применим для многих биохимических, диагностических и структурно-функциональных исследований макромолекул, в том числе белков и ДНК.
Содержание дейтерия (D) и протия (Н) в воде измеряют разными методами, в частности, на масс-спектрометрах различных марок. При этом используют, кроме стандарта SMOW, другой стандарт Hs.F-1 – полиэтиленовую пленку, в которой водородный изотопный состав всегда постоянен. В ней водорода всегда 98,8+4,3‰. Его содержание и изотопный состав не меняется.
Расчет содержания дейтерия проводится по следующей по формуле:
δD = (Rобразец-Rстандарт)/Rстандарт х 1000‰,
где Rобразец – исследуемая вода,
Rстандарт – стандарт SMOW.
Абсолютное содержание дейтерия в обычной воде SMOW 0,015576 ат.%.
Конечно, в домашних условиях полностью очистить воду от дейтерия невозможно, что бы не говорили многочисленные народные умельцы и целители. Также невозможно визуально на глаз отличить кристаллы тяжёлой воды от обычной воды.
Но существуют некоторые методы, которые могут на 40-60% очистить воду от дейтерия. О них уже неоднократно сообщалось на нашем сайте. Например, метод приготовления “протиевой” воды по методу А. Маловичко. Метод состоит в следующем: Эмалированную кастрюлю с отфильтрованной или обычной водопроводной водой нужно поставить в морозильную камеру холодильника. Через пару часов нужно достать её. Поверхность воды и стенки кастрюли уже будут прихвачены первым льдом. Эту воду нужно слить в другую кастрюлю. Лёд, что остался в пустой кастрюле, содержит в себе молекулы тяжёлой воды, которая замерзает раньше, чем обычная вода, при +3,8 0C. Этот первый лёд, содержащий тяжёлую воду, выбрасывают. А кастрюлю с водой снова поставить в морозильник. Когда вода в ней замерзает на две трети, незамёрзшую воду нужно снова слить – это вода, которая содержит всю химию и вредные примеси. А тот лёд, который остался в кастрюле – это и есть очищенная от дейтерия вода, которая необходима организму человека. Она очищена от примесей и тяжёлой воды на 60% и содержит 15 мг кальция на один литр жидкости. Нужно растопить этот лёд при комнатной температуре и пить эту воду в течении суток.
О другом методе очистки воды от дейтерия сообщил мне инженер М. М. Муратовым. Им сконструирована установка, позволяющая получать лёгкую воду заданного солевого состава с пониженным содержанием в ней тяжёлой воды в домашних условиях методом равномерного замораживания. Статья в комсомолке с докладом А.А. Тимакова "Основные эффекты легкой воды" на 8-й Всероссийской научной конференции по теме "Физико-химические процессы при селекции атомов и молекул" 6 - 10 ноября 2003г., вызвала интерес у инженера М.М. Муратова и решив проверить свойства этой воды, он с ноября 2006 г. стал "облегчать" воду для приготовления пищи и питья равномерным вымораживанием.
По методу М.М. Муратова вода аэрировалась и охлаждалась с образованием циркулирующего в емкости потока воды, до момента образования мелких кристаллов льда. После чего фильтровалась. На фильтре оставалось менее 2% льда, содержащего тяжёлую воду.
По данным автора этого метода 6-х месячное употребление легкой воды показало: При употреблении в пище и питье в сумме 2.5-3 литра в сутки значительное улучшение самочувствия на 5-й день употребления. Это выразилось в том, что прошли сонливость и хроническая усталость, исчезли “тяжесть” в ногах, уменьшились сезонные аллергические проявления без употребления лекарств. За 10 дней, заметно, около 0.5 диоптрии улучшилось зрение. Спустя месяц прошли боли в коленном суставе. Спустя 4 месяца исчезли симптомы хронического панкреатита и прошли небольшие боли в области печени. За 6 месяцев прошли боли связанные с ИБС и боли в области спины и поясницы. 1 вирусная инфекция прошла в очень легкой форме, “на ногах”. Уменьшились проявления варикозного расширения вен. Также отмечено заметное улучшение вкусовых качеств и воды, и продуктов приготовленных с применением обработанной воды. Последний факт подтвержден дегустационной комиссией промышленного предприятия, и хорошо заметен обычным потребителям воды.
Пожалуй, этими двумя доступными методами исчерпываются методы очистки воды от дейтерия в домашних условиях. Но если Вы так хотите пить лёгкую воду, почти полностью очищенную от дейтерия, попробуйте продукцию компании “Лангвэй”.
Лёгкая вода – это вода, очищенная от тяжёлой воды. Изотоп водорода, дейтерий, отличающийся наличием в ядре «лишнего» нейтрона, может образовывать с кислородом молекулу воды. Такая вода, в молекуле которой атом водорода замещён атомом дейтерия, называется тяжёлой. Содержание дейтерия в различных природных водах очень неравномерно. Оно может меняться от 0,03 % (относительно общего количества атомов водорода) – это вода из Антарктического льда, - самая лёгкая природная вода – в ней дейтерия в 1,5 раза меньше, чем в морской воде. Талая снеговая и ледниковая воды в горах и некоторых других регионах Земли также содержат меньше тяжелой воды, чем та, которую мы обычно пьем.
Лёгкая питьевая вода «Лангвей» производится с различным остаточным содержанием дейтерия (от 125 до 50 ppm). Она фасуется в бутылки ПЭТ емкостью 0,55 л и 1,5 л) и предназначена для питья и приготовления пищи. На основании клинических испытаний, проведенных в Российском Научном Центре восстановительной медицины и урортологии и в Институте красоты, легкая питьевая вода «Лангвей» рекомендована в качестве ежедневного напитка для нормализации углеводного и липидного обмена, артериального давления, коррекции веса, улучшения работы желудочно-кишечного тракта, увеличения скорости водообмена и выведения шлаков и токсинов из организма.
Таблица. Сравнительная характеристика легкой питьевой воды "Лангвей" и минеральных вод известных марок
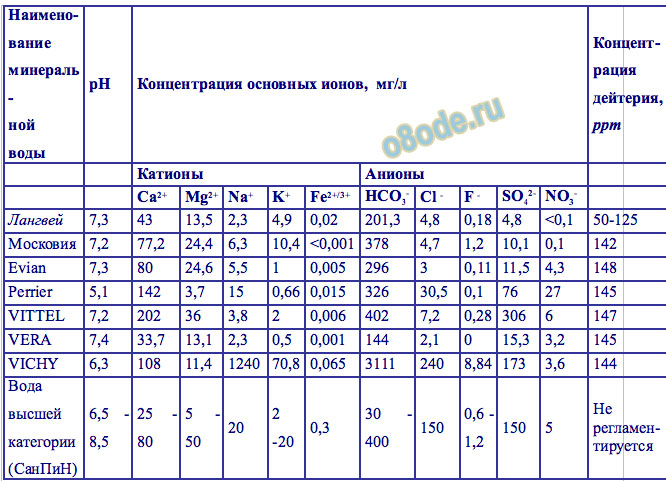
Подобная технология позволяет произвести очистку природной воды от дейтерия до рекордных величин порядка 1-2 ppm. Это по-настоящему химически чистая лёгкая вода заданного изотопного состава. Кроме того, производительность очистки воды этим методом на порядок величин выше любого другого способа, что, соответственно, снижает ее стоимость. При широкомасштабном производстве лёгкой воды, в будущем она станет доступной любому человеку.
Лёгкая вода «Лангвей» рекомендуется для быстрой и глубокой очистки организма, что необходимо при нарушениях обменных процессов, перед операцией и в послеоперационный период, а также при лечении опухолевых заболеваний.
У человека повышается физическая активность, появляется дополнительная энергия, отступают болезни, замедляется процесс старения.
Легкая вода «Лангвей» незаменима при:
повышенном артериальном давлении;
сахарном диабете;
избыточной массе тела.
Для достижения хорошего очищающего и оздоравливающего эффекта воду необходимо пить курсом не менее 3-4-х месяцев.
Клинические испытания легкой воды «Лангвей» с остаточным содержанием дейтерия 60-100 ррм, проведенные РНЦ восстановительной медицины и курортологии МЗ РФ, показали, что она может быть рекомендована как вспомогательное средство в комплексном лечении больных метаболическим синдромом (артериальная гипертония, ожирение, нарушение углеводного обмена, дислипидемия) и сахарным диабетом.
Кроме того, было обнаружено, что легкая вода улучшает качество жизни при почечно-каменной болезни и различных нарушениях в работе желудочно-кишечного тракта (колиты и гастриты).
По данным профессора Г.Д. Бердышева, много лет успешно использующего легкую воду в своей практике, даже небольшая (на 10-15%) очистка природной воды от тяжелой способна превратить её в биологический стимулятор.
Многочисленные эксперименты по оценке биологической активности легкой воды показали, что она, действительно, является более благоприятной средой для жизни, чем обычная вода.
За рубежом легкая питьевая вода применяется в качестве ежедневного профилактического противоракового средства. В США легкая вода стала питьевой водой многих голливудских звезд, а в Японии объем ее потребления удваивается каждый год.
В настоящее время компания по производству лёгкой воды Лангвэй – это динамично развивающаяся на российском рынке компания, которая использует современные научные разработки наших и зарубежных учёных.
С уважением,
к.х.н. О.В. Мосин
Я не понял а почему санпин не регламентирует содержание дейтерия в воде???
Миллиардеры пьют водичку с ледников Антарктиды. Которая замёрзла более миллиона лет назад. Там нет дейтерия. Почитай воздействие на организм и мозг. Провоцирует слабоумие. Умным - все! Дураками- дейтерий!😂🤔