Загадочный дейтерий и его свойства
О.В. Мосин
ДЕЙТЕРИЙ (от греческого deuteros-второй) (тяжелый водород) D, стабильный изотоп водорода с нуклеарной массой 2 ат. ед.
Ядро атома дейтерия - дейтерон состоит из одного протона и одного нейтрона, причём энергия связи между ними равна 2,23 МэВ.
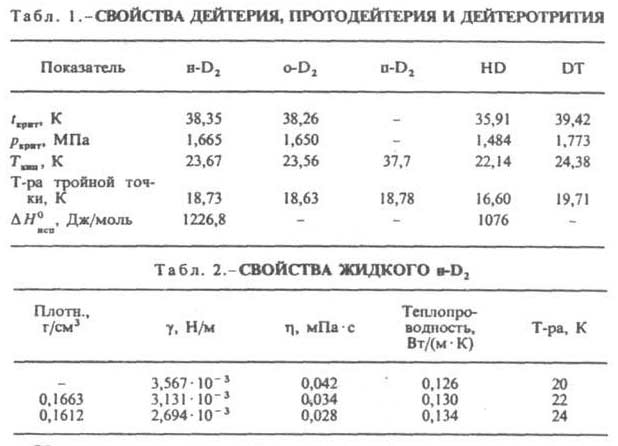
Поперечное сечение ядерной реакции (n,) 53.1033 м2, поперечное сечение захвата тепловых нейтронов дейтеронами 15.1032 м2 (для протонов 3.1029м2). Молекула двухатомна, длина связи 0,07417 нм; основная частота колебаний атомов в молекуле 3118,46 см1; энергия диссоциации 440 кДж/моль, константа диссоциации К = p2D/pD2 = 4,173.1073 (293,15 К). С другими изотопами водорода дейтерий образует молекулы протодейтерия HD (мол. м. 3,02205) и дейтеротрития DT (мол. м. 5,03034). В прибрежной морской воде соотношение D/(D + Н) составляет (155-156).106, в поверхностных водах - (132-151).106, в природном газе - (110-134).106.
Свойства. Коэффициент сжимаемости дейтерия (pV/RT)при 273,15 К: 1,0121 (2,0266 МПа), 1,0624(10,133 МПа), 1,130(20,266 МПа). С° [в Дж/(моль.К)]: 20,81 (20 К), 30,11 (100 К), 29,30 (298 К); теплопроводность 0,135 Вт/(м.К) (25 К); 1,23.102 мПа.с (293,15 К).
Дейтерий растворяется в жидкостях (например, в бензоле, толуоле, октане, гептане, ССl4, CS2) лучше, чем газообразный водород, причем это различие возрастает с понижением температуры.
Молекула дейтерия может находиться в ортои пара-состояниях. Ортодейтерий (o-D2) имеет параллельную (одного знака) ориентацию ядерных спинов, а парадейтерий (п-D2) -антипараллельную. Это обусловливает различие магнитных, оптических и термических свойств различных модификаций дейтерия. При обычных условиях дейтерий (нормальный Д., н-D2) представляет собой смесь 2/3 ортои 1/3 пара-модификаций, которые могут взаимно превращаться друг в друга (орто-пара-превращение). Каждой данной конфигурации соответствует определенный равновесный состав (равновесный дейтерий, p-D2). Так, доля п-D2 составляет: 0,333 (при 300 К), 0,251 (60 К), 0,148 (40 К), 0,019 (20 К). При низких температурах термодинамически стабилен o-D2. Самопроизвольное орто-пара-превращение дейтерия при низких температурах происходит очень медленно, что позволяет получить жидкий дейтерий, близкий по составу к нормальному. Орто-пара-превращение ускоряется в присутствии катализаторов (Fe, Сr, Со, Мn, Pd).
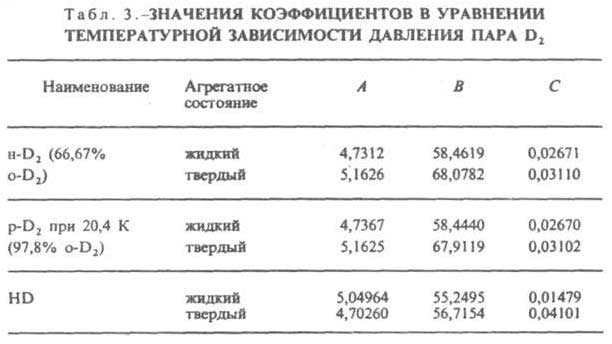
Ур-ние температурной зависимости давления пара над твердым и жидким Д.: lg 0,0075p (Па) = А - В/Т + СT (значения А, В и С приведены в табл. 3).
Теплота испарения o-D2 (в Дж/моль): 1202,9 (24,25 К), 1029,5 (30,53 К). Твердый дейтерий имеет тетрагон, объемноцентрированную решетку, а = 0,338 нм, с = 0,560 нм; т. пл. 18,73 К. Водород и дейтерий не изоморфны, обнаружена их ограниченная взаимная растворимость в твердом состоянии. При 4,2 К предельная растворимость дейтерия в водороде 10% по объему, а растворимость водорода в дейтерии 21%.
По химическим свойствам дейтерий аналогичен водороду, однако скорость реакций при замещении водорода на дейтерий заметно уменьшается, например, при окислении органических соединений водорода с хлором - в 5-10 раз.
При электролизе воды дейтерий выделяется медленнее, чем водород. Важное практическое значение имеют реакции изотопного обмена дейтерия. Константа равновесия реакции Н2 + D2 2HD составляет: 1,345 (50 К), 2,903 (200 К), 3,44 (373,15 К), 3,80 (700 К). Осуществляют ее в присутствии катализатора (Pt, Ni). Для реакции НDО(ж) + D2(г) D2О(ж) + HD(г) (где ж -жидкость, г - газ) константа равновесия: 3,96 (223,15 К), 2,92 (323,15 К), 2,40 (373,15 К). Для р-ции Н2О(ж) + HD НDО(ж) + Н2(г) константа равновесия: 4,69 (223,15 К), 3,37 (323,15 К), 2,69 (373,15 К). Изотопный обмен между водой и D2 или HD может протекать в паровой фазе в присутствии катализаторов (Ni) или в жидкой под давлением (из-за плохой растворимости изотопов водорода в воде) в присутствии катализаторов (в т. ч. гидрофобных) в гомогенной или гетерогенной системе. Некоторые реакции изотопного обмена водорода на дейтерий протекают очень быстро, например, в группах ОН (щелочи, спирты) и NH (NН3, амины).
Важнейшие соединение дейтерия - тяжелая вода. Дейтериды соединения, аналогичные гидридам. Большое практическое значение имеет дейтерид лития 6LiD – ocновной компонент заряда термоядерного (водородного) оружия. Для аналитического определения дейтерия применяют масс-спектрометрические, спектральные, хроматографические, а также денсиметрические (путем измерения плотности) методы изотопного анализа.
Получение. Дейтерий выделяют из тяжелой воды, например, электролизом. Дейтерий получают также низкотемпературной ректификацией из водорода или азотоводородной смеси для синтеза NH3 (водород которой содержит 250-300 м. д. HD). Исходный водород или азото-водородную смесь после тщательной очистки от примесей (О2 до 109 мольных долей, остальные газы - до 107-108 мольных долей) сжижают и двухступенчатой ректификацией при 22-24 К и обрабатывают HD. Зачем в присутствии катализатора образуется смесь Н2 + D2 + HD, из которой низкотемпературной ректификацией получают 99,8%-ный газообразный дейтерий. Сжиганием с воздухом или О2 последний переводят в тяжелую воду.
Применение. Дейтерий в виде тяжёлой воды - замедлитель нейтронов в ядерных реакторах. Дейтероны, обычно получаемые путем ионизации атомов дейтерия, используются в качестве бомбардирующих частиц в ядерных реакциях, в частности для получения быстрых нейтронов.
Дейтерий применяется также как изотопный индикатор в научных исследованиях в химии, биологии, физиологии, агрохимии и др. (в т.ч. в опытах с живыми организмами и при диагностич. исследованиях человека).
Соединения дейтерия используются также при спектроскопических исследованиях. Изделия из монокристаллов на основе KD2PO4 применяются для создания систем управления и преобразования лазерного излучения.
Дейтерий - ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетич. реакторах такого типа предполагается осуществить реакцию D + T He + n + 17,6 МэВ.
Литература.: Выделение дейтерия из водорода методом глубокого охлаждения, М., 1961; Тупицын И. Ф., Тяжелые изотопы водорода, дейтерий и тритий, М., 1961; Андреев Б. М., Зельвенский Я. Д., Катальников С. Г., Тяжелые изотопы водорода в ядерной технике, М., 1987 Я. Д. Зельвенский.